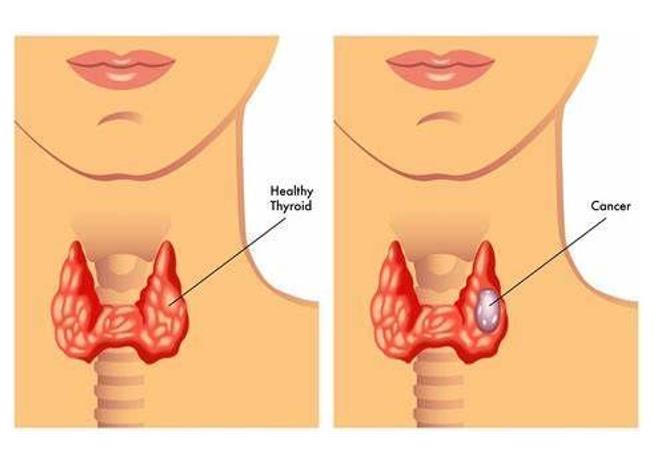
该sNDA基于关键3期COSMIC-311试验的结果。数据显示,与安慰剂组相比,Cabometyx治疗组无进展生存期(PFS)有显著改善。
2021年2月,基于该试验结果,FDA授予了Cabometyx突破性疗法认定(BTD),用于治疗先前治疗后病情进展、放射性碘难治性(若放射性碘适用)的DTC患者。
Exelixis公司总裁兼首席执行官Michael M. Morrissey博士表示:“FDA受理sNDA并进行优先审查,是朝着我们的目标迈出的重要一步,我们的目标是将Cabometyx带给先前治疗过的放射性碘难治分化型甲状腺癌患者。
考虑到接受抗VEGFR治疗后缺乏标准护理,3期COSMIC-311试验中已证明的无进展生存益处意味着,如果获得批准,Cabometyx有潜力成为这些患者的一种重要新治疗方法。”

COSMIC-311是一项多中心、随机、双盲、安慰剂对照3期临床试验,在先前接受过2种血管内皮生长因子受体(VEGFR)靶向疗法治疗后病情进展的患者中开展。
该研究旨在全球150个地点招募大约300例患者。研究中,这项患者按2:1的比例随机分组,接受每天一次口服Cabometyx 60毫克或安慰剂。主要终点是无进展生存期(PFS)和客观缓解率(ORR)。
数据显示,研究达到了主要终点:与安慰剂组相比,Cabometyx组无进展生存期(PFS)显著延长。在此次计划的中期分析中,与安慰剂相比,Cabometyx将疾病进展或死亡风险降低了78%(HR=0.22;96%CI:0.13-0.36;p<0.0001)。
该研究中的安全性与之前观察到的Cabometyx安全性一致。该试验的详细结果在2021年美国临床肿瘤学会(ASCO)年会上公布,并于2021年7月发表于《柳叶刀-肿瘤学》(The Lancet Oncology)。
Cabometyx的活性药物成分为cabozantinib,这是一种酪氨酸激酶抑制剂(TKI),通过靶向抑制MET、VEGFR2 及RET信号通路而发挥抗肿瘤作用,能够杀死肿瘤细胞,减少转移并抑制血管生成。
在美国和欧盟,Cabometyx被批准用于治疗晚期肾细胞癌(RCC)患者,以及既往接受过索拉非尼(sorafenib)治疗的肝细胞癌(HCC)患者。(生物谷Bioon.com)
原文出处:Exelixis Announces U.S. FDA Accepts for Priority Review the Supplemental New Drug Application for CABOMETYX (cabozantinib) for Patients with Previously Treated Radioactive Iodine-Refractory Differentiated Thyroid Cancer
文章来源:放射性碘难治分化型甲状腺癌(DTC)新药!Cabometyx(卡博替尼)美国获优先审查:疾病进展/死亡风险↓78%!生物谷
推荐阅读:
女性在试管婴儿,对子宫内膜厚度有要求?对胚胎的容受性是什么?
最近有一位母亲为保胎打500多针,那孕妇有什么征兆,需要保胎呢?
你有这样的生理期现象吗?你知道姨妈味是什么味吗?姨妈的这些事
孕妇患有缺铁性贫血对胎儿有什么影响?要怎么护理这样的孕妇呢?
身为女性的你,知道健康的私处是什么气味吗?来好好认识一下私处