导读:即将进入III期临床!
全球战“疫”已历时一年半,已有14款新冠疫苗获批紧急使用或上市。然新冠病毒仍旧在全球加剧蔓延,这场人类历史上百年难遇的传染性疾病,仍未到达人类最终胜利的拐点。作为预防和控制传染病最有效、最经济的手段,新冠疫苗的研发进展一直倍受关注。
又一款国产新冠疫苗取得进展
丽珠生物重组蛋白疫苗II期试验数据亮眼
据药智网获悉,近日,《中华医学杂志》发布了上市公司丽珠集团旗下丽珠生物全资子公司丽珠单抗的新冠疫苗V-01的II期临床试验数据,结果进一步证实V-01的免疫原性和安全性特征有利,同时与单剂接种方案相比,两剂接种方案诱导的免疫原性特征更佳,并表示有望在不久后步入III期临床,以展开基于大规模人群的安全性和有效性评估。
中国临床试验注册中心网站信息显示,丽珠生物于今年4月7日注册II期临床为随机、双盲和安慰剂对照试验,由广东省疾控中心及高州市疾控中心实施研究;以两周进行免疫观察,两剂组成人和老人受试者各分别入组280例,单剂量组成人和老人受试者各分别入组160例,合计纳入880例受试者,以检测不同剂量、不同免疫程序重组新型冠状病毒融合蛋白疫苗的免疫原性及安全性。
现II期临床结果公布,初步数据显示,V-01的安全性特征良好,不良反应比例低且程度轻微。接种V-01的≥60岁受试者中,不良事件的严重程度轻于18-59岁受试者。换言之,V-01疫苗在老年组表现出相当好的安全性。
具体体现在10μg、25μgV-01两剂量组以及50 μg V-01单剂量组中,老年组的不良事件百分比分别为19.2%、25.8%、17.5%,而青年组分别为 34.2%、23.3%、26.7%;局部不良部位疼痛患病率老年组分别为5.0%、0%、2.5%、3.3%和15.0%,青年组分别为7.5%、5.0%、12.5%、7.5%和30.0%。此外,在两剂10μg组中,并未出现因接种V-01所致的任何3级不良事件(发热和疼痛)。
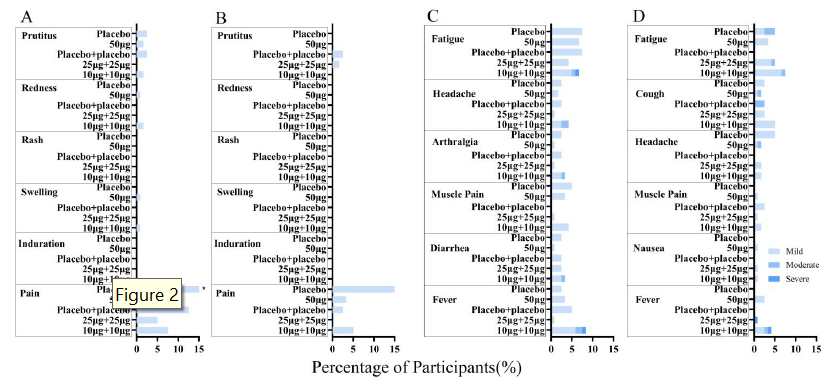
图一:重组融合蛋白疫苗(V-01)II期试验按年龄分层的征集性局部不良事件和全身不良事件
在中和抗体水平方面,V-01在两剂量组实验中激发了显著的免疫反应,显示出较高水平的中和抗体滴度水平和抗RBD免疫球蛋白。数据显示,10μg和25μg的V-01两剂量给药方案中,青年组中和抗体滴度分别为161.9和 149.3,约3倍康复患者血清滴度;老年组中和抗体滴度分别为111.6和111.1,约2倍康复患者血清滴度。

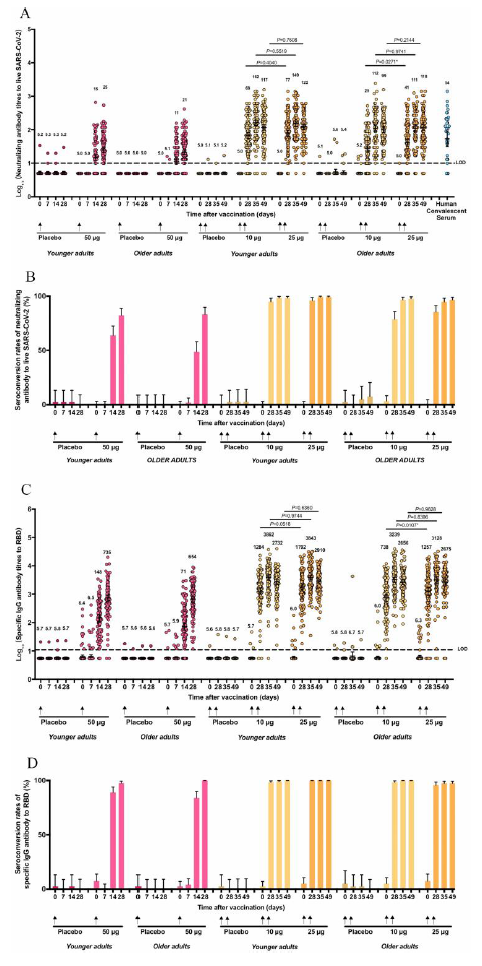
图二:重组融合蛋白疫苗(V-01)II期试验体液免疫应答
综合数据来看,丽珠生物V-01具良好的安全性及免疫原性,尤其在II期临床专门设置的60岁以上老年组试验中 ,表现出更高的安全性与诱导产生的较高中和抗体滴度,鼓舞了新冠疫苗的研发,为新冠疫苗技术发展与预防和控制新冠疫情展示出了新的希望,有望成为“全年龄段疫苗”。
国产上市已有7款
V-01破防突围优势在哪儿?
值得提及的是,V-01疫苗是丽珠生物自2020年7月联合中国科学院生物物理研究所彭华研究团队,合作研发的一种创新型新冠重组蛋白疫苗;为全球首个以新型冠状病毒刺突糖蛋白(S蛋白)的受体结合区(RBD)作为抗原,并采用分子内佐剂及Fc融合蛋白设计的新型重组新冠疫苗,不仅能激发体液免疫,还能产生良好的细胞免疫应答。属于我国新冠疫苗五条技术路线中的重组蛋白疫苗技术路线。
据公开数据显示,目前我国已有7款新冠疫苗获批紧急使用或上市,22个新冠疫苗进入临床试验,其中4款为重组蛋白技术路线,分别是智飞生物的ZF001、三叶草生物制药的SCB-2019、丽珠生物的V-01、以及刚进入临床的国药新冠重组蛋白疫苗。
其中智飞生物的ZF001已获批紧急使用,三叶草生物SCB-2019全球II/III期临床试验完成了成人和老年人群的招募。
尽管目前智飞生物的ZF001已获批紧急使用,丽珠生物未能抢到新冠疫苗的首发优势,但是研究人员认为丽珠生物的V-01优于ZF001及三叶草的SCB-2019。
首先从接种剂数而言,丽珠疫苗只需接种2针,减少多次注射的繁琐过程;且两剂21天接种就诱导出了很强的体液免疫应答,中和抗体滴度最高达到了康复者血清的3倍;其次是II期临床在老年组也诱导出了较高的中和抗体滴度,展示出较高的安全性和免疫原性。
表1:国内重组蛋白新冠疫苗对比

注:由于国药的新冠重组蛋白疫苗刚进入临床,暂无数据作对比
此外,值得注意的是,在过去几十年里,尽管重组蛋白技术已经成为安全高效、相对便宜、 在微生物和其它宿主表达系统中均可广泛使用的技术;但佐剂是限制其发展的一个卡脖子技术难关,因佐剂很大程度上决定传统疫苗的效力和安全性,传统佐剂存在激发细胞免疫不足的缺陷,并极大可能伴有一定的副作用;新型佐剂的研发和使用又增加了生产成本,产生的副作用更使疫苗应用顺应性降低。
而丽珠生物绕过佐剂短板,凭单抗的研发经验发力在蛋白设计上,V-01创新性地融合了作为生物佐剂的人源细胞因子等免疫活性成分,实现了佐剂作用的平衡。使其在极小剂量,或者没有佐剂的情况下也具有极强免疫原性,为预防新冠病毒提供了更加高效的方法,具有更好的前景与优势。
优势凸显,商业化条件具备
能否获紧急使用授权机会?
在当下新冠病毒变株,产能供应不足,制约着新冠疫苗保护效力的困境下,丽珠生物从II期临床数据展现出了持久保护性免疫,适用所有年龄段的潜力;此外,V-01还具备重组蛋白疫苗的基本特点,生产成本低、安全性良好、2-8°C冷链运输储存及大规模生产等优势。无疑,一旦丽珠生物疫苗V-01成功上市,将会是新冠疫苗技术研发的一个重要突破,有效解决当前的疫苗紧缺问题,提高优良新冠疫苗的可及性。
据悉,随着I、II期临床试验的顺利开展,针对新冠病毒突变株问题,丽珠生物在V-01之外还布局了相应的管线,目前正在稳步推进研发工作。与此同时,为尽早满足全球对于新冠疫苗的需求,丽珠已建设“V01产业化项目”,包括1条原液生产线、2条制剂生产线、以及1条预留制剂生产线的空间,拟增加生产规模:病毒重组蛋白疫苗原液4亿支、制剂2亿支;为疫苗的早日上市实现商业化创造条件。
不过最终V-01能否成功上市,加速实现商业化,还要取决于其III期临床试验结果,期待丽珠生物更多好消息!同时也希望能如智飞生物ZF001一样,凭借现有的良好试验结果,能够快速获得紧急使用授权的机会,为中国乃至全球的抗击新冠病毒“战疫”作贡献。
参考文献:
-
New Vaccine Hopes, Adverse Reactions, & a Developer Clashing With Regulators: A Month of Highs & Lows - Absolutely Maybe
-
Immunogenicity and safety of a recombinant fusion protein vaccine (V-01) against COVID-19 in healthy adults: a randomized, double-blind, placebo-controlled, phase Ⅱ trial
-
评价重组新型冠状病毒融合蛋白疫苗在健康人群安全性和免疫原性随机、双盲、安慰剂对照的Ⅰ期临床试验http://www.chictr.org.cn/showproj.aspx?proj=124140
-
丽珠集团:关于获得药物临床试验批件的公告http://data.eastmoney.com/notices/detail/000513/AN202103231475384778.html等
推荐阅读: