看点:
1、24个新药获得临床试验默示许可,包括12个国产1类新药
2、CDE新受理29个新药(43个受理号)的临床试验申请
3、石药集团大爆发!今年已有9款1类新药获批临床
4、复兴凯特CAR-T产品新适应证获批临床
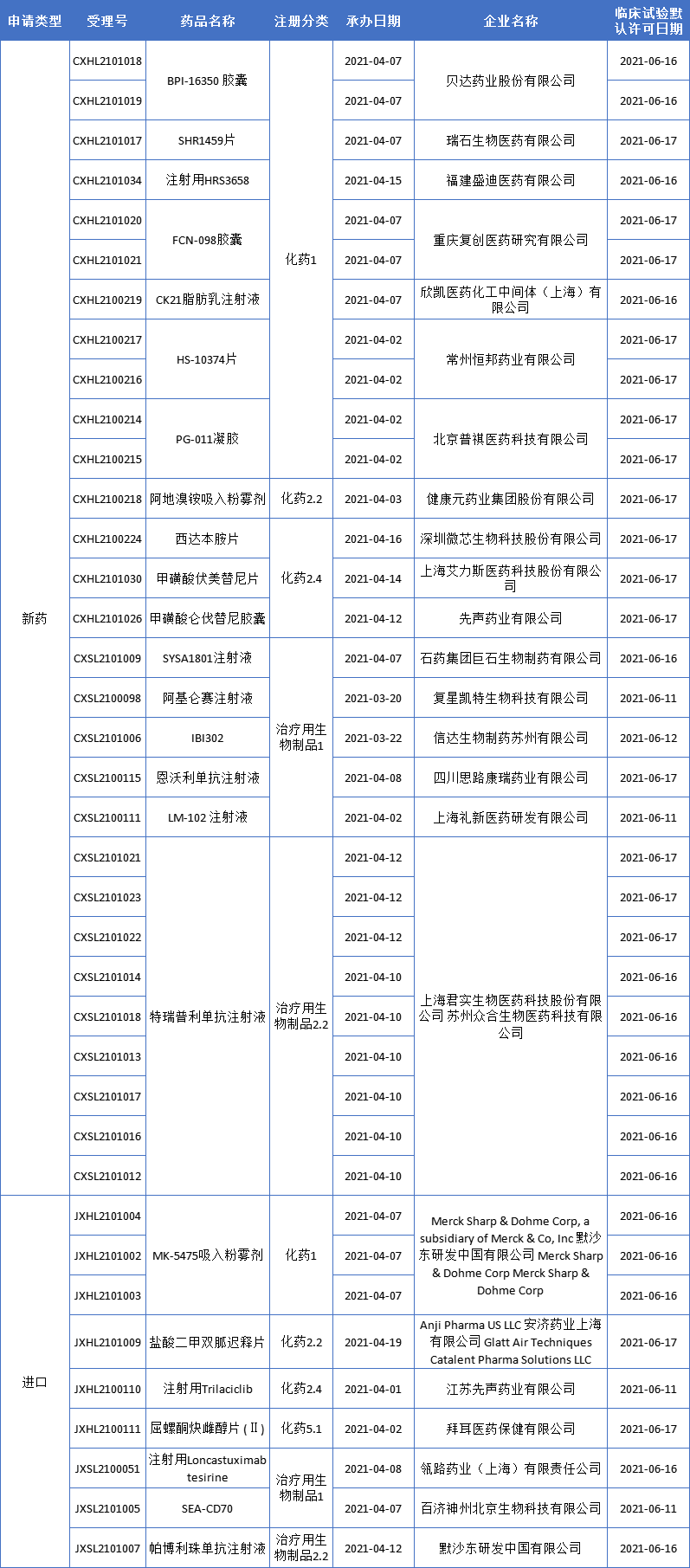
药智数据显示,本期(6月11日至6月18日)有24个新药获批临床(38个受理号);另有29个品种(43个受理号)临床申请获CDE承办受理,更多动态如下:
新药临床申请·新获批
本期,24个新药(38个受理号)获得临床试验默示许可,包括12个国产1类新药。获批临床的创新药有CDK4/6抑制剂、BTK抑制剂、TRK抑制剂、ADC、CAR-T等,涵盖糖尿病性黄斑水肿(DME)、血液肿瘤、实体瘤等适应症。
数据来源:药智数据
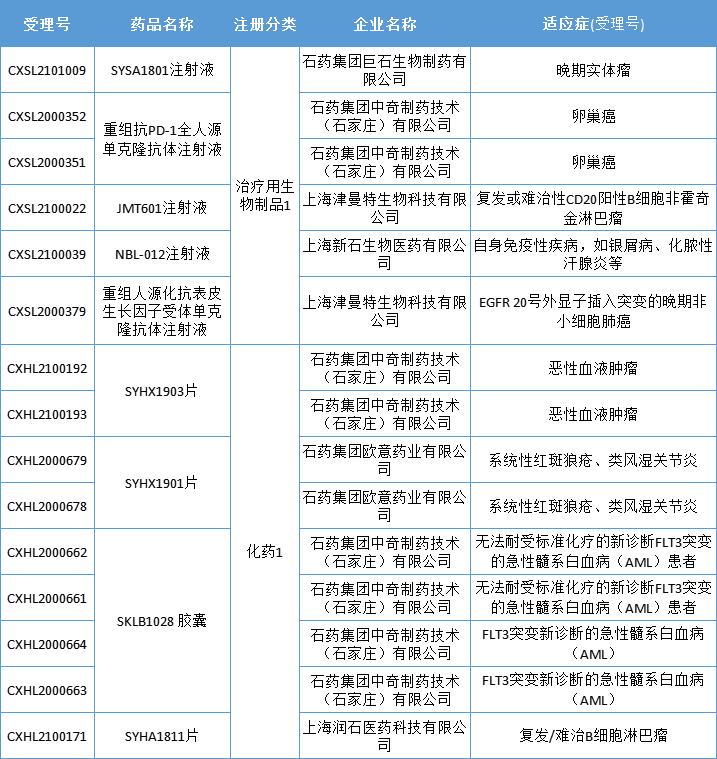
1.SYSA1801注射液
该药是石药集团开发的一款抗Claudin 18.2单克隆抗体药物偶联物(ADC),临床前体外和体内的动物试验显示其能有效通过抗Claudin 18.2抗体靶向肿瘤细胞并发生内吞,将小分子毒素带入肿瘤细胞而起到治疗肿瘤作用。本次获批临床试验的适应症为Claudin 18.2表达实体瘤。
药智数据显示,今年石药集团已有9款1类新药在中国获批临床试验,涉及CDK9、JAK/SyK、BTK、CD20/CD47等当下热门靶点。
数据来源:药智数据
2.阿基仑赛注射液
该产品是根据美国Kite公司的CAR-T产品 Yescarta®经技术转移而本地化生产。Yescarta®于2017 年 10 月在美国获批上市,2018 年 8 月在欧洲上市。2021 年 3 月,Yescarta®用于治疗惰性非霍奇金淋巴瘤获美国 FDA 批准于美国上市。
复星凯特于2017年从Kite Pharma引进Yescarta技术、并获授权在中国进行本地化生产的靶向CD19自体CAR-T细胞治疗产品。今年1月,阿基仑赛注射液的上市申请进入行政审批阶段,适应症为成人复发难治性大 B 细胞淋巴瘤。
本次新适应症获批临床,拟用于治疗接受过二线或以上系统治疗后复发或难治性惰性非霍奇金淋巴瘤(r/r iNHL),包含滤泡性淋巴瘤(FL)和边缘区淋巴瘤(MZL)。
3.IBI302
该药是信达生物自主研发的全球创新性双靶向特异性重组全人源融合蛋白,可以同时抑制VEGF介导的新生血管生成和补体活化通路。此前,IBI302已在中国获批针对wAMD、nAMD的临床研究,本次获批的临床研究适应症为:糖尿病性黄斑水肿(DME)。
4.恩沃利单抗注射液
该药是人源化PD-L1单域抗体和人免疫球蛋白IgG1 Fc片段的新型融合蛋白,是全球首个皮下注射PD-(L)1。思路迪医药负责该产品的肿瘤领域的临床开发,康宁杰瑞作为原研方负责质量和独家生产,先声药业负责该产品在中国大陆的独家商业化推广。
目前,该药已向NMPA申请上市,相关适应症包括既往标准治疗失败的微卫星不稳定(MSI-H)/错配修复功能缺陷(dMMR) 晚期结直肠癌、胃癌及其他晚期实体瘤。本次获批的是一项评价恩沃利单抗联合仑伐替尼治疗晚期实体瘤的多中心、开放标签、Ib/II期临床研究的试验。
5.LM-102 注射液
该药是礼新医药的一款Claudin 18.2抗体,获批临床的适应症为CLDN18.2阳性的晚期实体瘤。Claudins是一类蛋白质家族,其中Claudin-18具有两个剪接变体,分别为Claudin 18.1和Claudin 18.2。Claudin 18.1在正常肺的细胞中选择性表达,Claudin 18.2在正常细胞中表达高度受限,但在多种肿瘤中频繁异位激活和过表达。理论上,通过抑制Claudin 18.2,可以起到抗肿瘤作用。
6.BPI-16350 胶囊
该药是贝达药业自主研发的一种新分子实体化合物,针对的靶点为细胞周期蛋白依赖性激酶4/6(CDK4/6),拟单药或与激素疗法联合,主要用于治疗HR阳性/HER2阴性的晚期或转移乳腺癌患者,还可能用于Rb+的其他癌症的一、二线或联合治疗。
2018年6月,BPI-16350获得国家药品监督管理局的批准开展单药用于晚期实体瘤的临床试验,目前Ⅰ期临床研究正在进行中。本次获批开展BPI-16350联合非甾体类芳香化酶抑制剂(来曲唑/阿那曲唑)或氟维司群治疗乳腺癌的Ⅰb/Ⅱ期临床试验。
7.FCN-098胶囊
该药是复星医药子公司重庆复创医药研发的1类新药,是一种新型的第二代原肌球蛋白受体激酶(TRK)抑制剂,在体内和体外均克服了TRK耐药突变。本次获批用于治疗晚期恶性实体瘤临床试验。
8.注射用Loncastuximab tesirine
该药由瑞士ADC Therapeutics SA研发,是一种靶向CD19抗原的ADC产品,由CD19单抗与吡咯苯二氮平(PBD)二聚体毒素偶联构成。本次获批临床适应症为治疗失败的复发/难治性弥漫性大B细胞淋巴瘤患者。
9.SEA-CD70
该药是Seagen公司开发的一款靶向CD70的人源化无岩藻糖基化的单克隆抗体。2019年11月,百济神州和Seagen公司达成合作,获得了SEA-CD70在亚洲(除日本以外)、除美洲(美国、加拿大以及拉丁美洲国家)和欧洲以外全球其他地区的开发和商业化权利。本次获批的临床研究适应症为:复发/难治性骨髓增生异常综合征和急性髓系白血病。
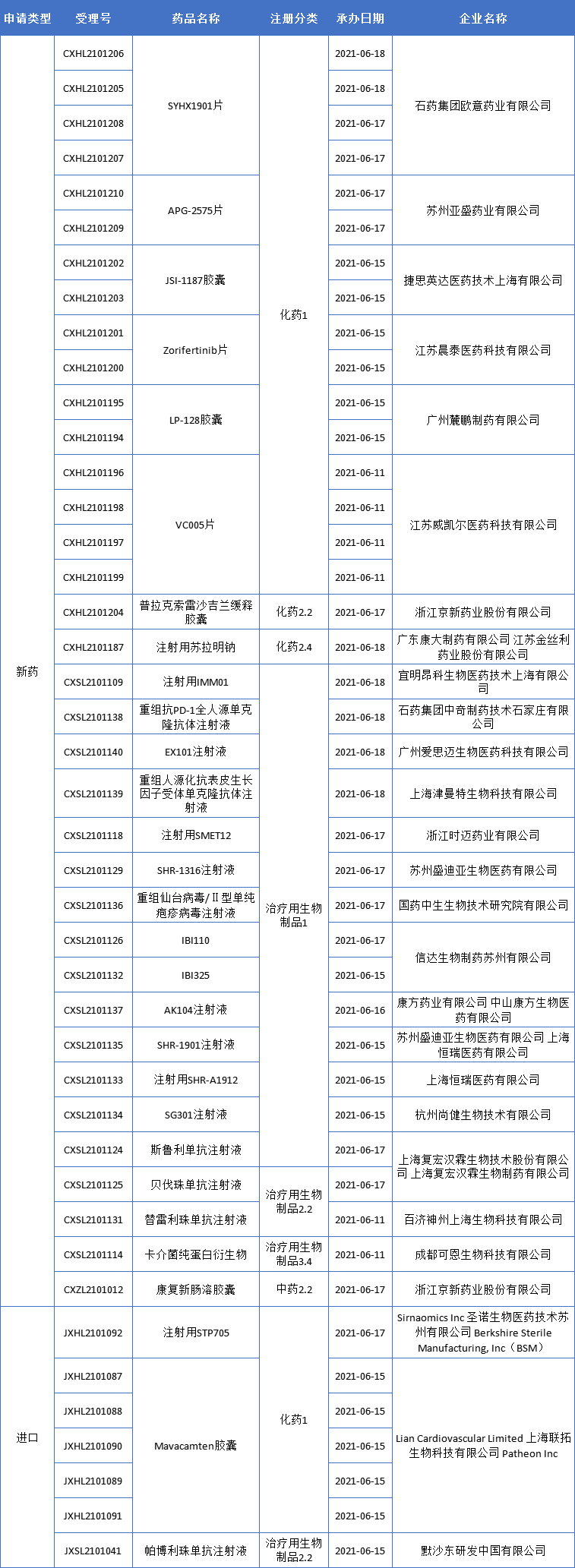
新药临床申请·新受理
本期,CDE新受理29个新药(43个受理号)临床申请。其中,26个品种(36个受理号)为国产新药,3个品种(7个受理号)为进口新药,更多动态如下:
数据来源:药智数据、企业公告等网络公开数据
信息来源:药智网、企业公告等网络公开信息
责任编辑:琉璃
推荐阅读:
283个药品不再生产了,其中就包括高血压药尼群地平,还能吃吗?
奥美沙坦是一种血管紧张素 II 受体阻滞剂,治疗高血压,耐受性良好
“神药”阿司匹林,能降低心梗、脑梗发生率,但容易发生胃肠道出血