医药创新来了一个“急刹车”?
自2015年中国药审改革,清除药品审评审批积压问题,同时加快药物审评审批速度等一系列鼓励新药创制、提升药品质量、促进产业升级的政策出台后;中国医药创新逐渐由“创新驱动”向着“全球性创新”方向迈进。
国内创新药获批数量更是逐年激增,2021年,国产创新药获批数量达到30个,包括化学药24个,生物药6个,其中抗肿瘤药物17个,抗感染和抗病毒药物7个。2021年,国家药品评审中心登记的创新药相关临床试验共501项,其中Ⅲ期临床共106个。曾被行业预测,未来3-5年,我国创新药上市将迎来爆发阶段。
新药“遇冷”,获批数量“锐减”
然而2022年现已过半,国内医药创新“遇冷”,尤其是1类化学创新药获批数量锐减。据药智数据统计,2022年1月至2022年6月30日,国家药监局仅批准5款1类化药上市(按品种计,下同),同比2021年上半年的18种新药,获批数量下降72.22%。

数据来源:药智数据
且值得提及的,今年上半年获批的5种1类新药,仅2款为国内药企自主研发获批上市的,分别是恒瑞医药的瑞维鲁胺、罗欣药业的替戈拉生;相对于2021年上半年获批的18种1类化药,有16种来自国内企业而言,更是大大缩水。
2022年上半年NMPA批准的1类化药
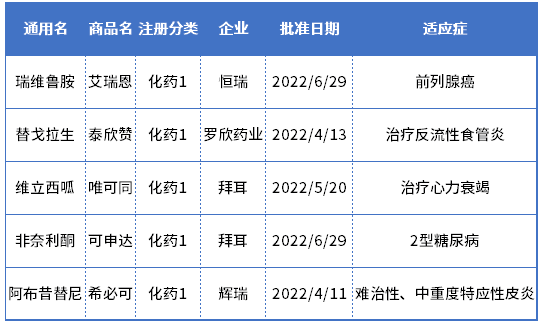
数据来源:药智数据
事实上,进入2022年不仅国内创新获批放缓,创新药出海也屡屡受挫或被延迟上市。2月10日,美国肿瘤药物咨询委员会(ODAC)拒绝了信达仅根据中国的临床试验数据就批准信迪利单抗上市;2月15日,要求其暂停LB1901(一款靶向CD4的CAR-T)在美国开展的I期临床试验;5月2日,君实生物PD-1单抗特瑞普利单抗联合吉西他滨/顺铂,要求进行一项质控流程变更。另外,回复信中还提及,由于受到新冠疫情影响,FDA的现场核查受阻;7月百济神州百泽安(替雷利珠单抗)新药上市许可申请(BLA)延长...
“新政”起效,中国创新药进入深度自我调整期?
为何会出现这种情况?正如FDA给予君实生物和百济神州的回复函而言,新冠疫情影响现场核查是不可否认的因素。但回归本土,或者深入原因,还有在各类鼓励创新政策引导下,创新药企进入“内卷”模式,药物靶点创新扎堆,对化学药创新药、抗肿瘤药的研发提出了比以往更高的要求。
事实上,自2021年下半年开始,由于国内药物研发基础相对薄弱,产品同质化问题,以及集采和医药支付等制约中国创新药发展。市场对创新药的高预期不再,创新药企IPO频频遭遇“破发”,创新型研究企业部分股价更是跌破“新低”。在新形势倒逼之下,创新药企进入深度的自我调整期。
2021年7月2日,CDE就发布了两份通知,《化学药品创新药上市申请前会议药学共性问题相关技术要求》、《以临床价值为导向的抗肿瘤药物临床研发指导原则》向社会公开征求意见。推动创新药赛道从上半场的“海选赛”,进入到下半场的“淘汰赛”。
如何进行高层次的创新、提升源头创新能力,解决未满足的临床需求成为摆在药企眼前的考题。尤其是“以患者为中心,以临床价值为导向”的药物创新导向,对新药研发提出更高的标准后。
中国创新药之路该怎么走?
在市场对创新药期许值降低,在国家对创新药提出更高的要求后,尤其是当Me-too变成We-too,Me-better要变得更加出彩时,中国创新之路该怎样走?
药智网联合创始人李天泉提出四个方向:一是走国际化道路,尽管目前创新药出海屡屡受挫,但在中国市场支付能力有限的情况下,以国际化大公司新药研发的全球视野,开发具有原创性新药“Firstinclass”的产品,扩大市场,提升,寻求更丰厚的回报,良性循环,才有更多的资金进行研发;如果没有国际化的实力,采用Licenseout方式,借助国外企业换种方式国际化。
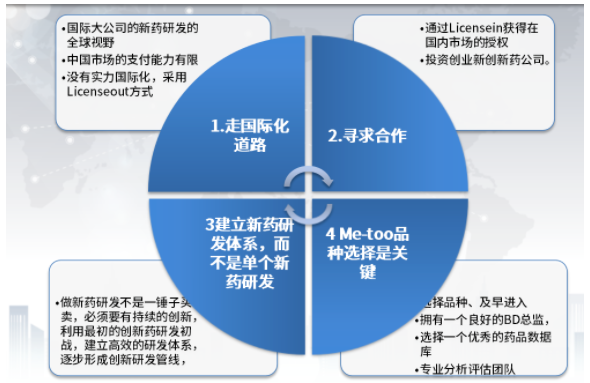
图片来源:药智网联合创始人李天泉演讲报告
二是寻求合作。通过Licensein获得在国内市场的授权,或者投资创业型创新药公司,据不完全统计,2021年,全球获批上市的创新药为85款,其中48款由新兴生物制药公司研发。可见这也是一种不错的选择。
三是建立新药研发体系,而不是耽搁新药研发。新药研发不是一锤子买卖,必须要有持续的创新,形成丰富、具有体系的创新研发管线。
四为品种选择是关键。选择品种、及早进入是关键,不要一味追求热点,注重差异化发展以及团队建设。
参考资料:
1.当Me-too变成We-too,中国创新药之路该怎么走?
推荐内容:
糖尿病患者的福音,屠呦呦的“天然药”,青蒿素也能治疗心脏病?
心脏备用小马达:心脏起搏器医保报销吗?起搏器的手术费用是多少?
皮肤瘙痒、水泡、红斑、肿胀、死皮,湿疹用什么药好得最快最有效