今日(11月8日),国家药监局官网发布公告,通过优先审评审批程序附条件批准合源生物科技(天津)有限公司申报的纳基奥仑赛注射液(商品名:源瑞达)上市。该药品用于治疗成人复发或难治性B细胞急性淋巴细胞白血病。
纳基奥仑赛注射液是通过基因修饰技术将靶向 CD19 的嵌合抗原受体(CAR)表达于 T 细胞表面而制备成的自体 T 细胞免疫治疗产品。输注至体内后会与表达 CD19 的靶细胞结合,激活下游信号通路,诱导 CAR-T 细胞的活化和增殖并产生对靶细胞的杀伤作用。
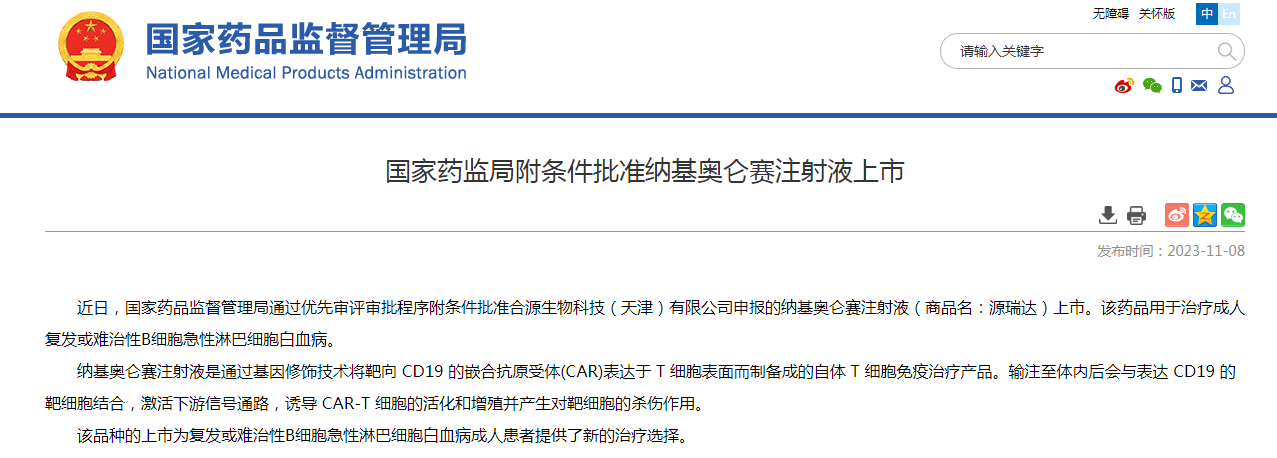
图片来源:NMPA官网
在国内,此前已有 2 款 CD19 CAR-T 疗法获批上市,分别为复星凯特的阿基仑赛(适应症为 r/r 大 B 细胞淋巴瘤)和药明巨诺的瑞基奥仑赛(适应症则为 r/r 大 B 细胞淋巴瘤、 r/r 滤泡淋巴瘤)。
据合源生物此前新闻稿,纳基奥仑赛注射液(CNCT19细胞注射液,Inaticabtagene Autoleucel)是首个中国全自主创新的靶向CD19的CAR-T细胞治疗产品,具有全球独特的CD19 scFv(HI19a)结构和国际领先的生产制造工艺,在成人r/r B-ALL注册临床研究中细胞药物生产成功率达到100%。
此前,纳基奥仑赛注射液已获得国家药品监督管理局“突破性治疗药物(BTD)”认定和美国FDA孤儿药资格认定(Orphan Drug Designation, ODD)。
急性淋巴细胞白血病(ALL)是一种起源于B系或T系淋巴祖细胞的恶性肿瘤,占成人急性白血病的20%-30%。其中前体B细胞类型的ALL占80%-85%。成人ALL恶性程度高,患者往往面临复发或难治(R/R),且成人复发或难治性ALL 预后极差,患者多于数月内死亡。
肿瘤免疫治疗兴起,为恶性肿瘤的治疗带来了曙光,靶向CD19的嵌合抗原受体T(CAR-T)细胞疗法在R/R 急性B淋巴细胞白血病(B-ALL)治疗领域取得了重大突破。
纳基奥仑赛注射液治疗中国成人R/R B-ALL的关键注册II期临床试验结果在2022年美国血液学会(ASH)年会公布。
截至2022年9月27日,39例成人r/r B-ALL患者接受了纳基奥仑赛注射液回输,具体试验数据如下:
持久的高缓解率:总体缓解率(ORR)达82.1%,中位随访9.3个月时,中位缓解持续时间(DOR)尚未达到。在3个月时仍缓解的患者中,1年时预计有80%患者在持续缓解中。无论是否后续接受造血干细胞移植,均能表现出持续缓解和长期生存获益。
显著降低的CAR-T治疗相关毒性严重性:3级及以上细胞因子风暴(CRS)发生率为10.3%;3级及以上免疫效应细胞相关神经毒性综合征(ICANS)发生率为7.7%,无非预期靶向CD19 CAR-T治疗导致的不良事件发生。
此外,纳基奥仑赛注射液治疗淋巴瘤(R/R B-NHL)及儿童和青少年R/R B-ALL的注册临床研究正在进行。纳基奥仑赛注射液用于治疗成人复发或难治性B细胞型急性淋巴细胞白血病(B-ALL)的IND申请已获美国FDA批准。
合源生物另一款双靶点CAR-T产品(HY004细胞注射液)的两项新药临床试验申请也已获NMPA默示许可,适应症分别为:治疗成人复发或难治性B细胞型急性淋巴细胞白血病(r/r B-ALL)和治疗复发或难治性B细胞非霍奇金淋巴瘤(r/r NHL)。
希望合源生物临床研究进展顺利,惠及更多患者。
文章来源:药智新闻
推荐内容:
脱发的你应该认识米诺地尔吧?为什么你用会没有效果?须知这些情况