2023年3月13日,Mersana Therapeutics宣布XMT-2056一期临床试验临床暂停。
Mersana向FDA通报,因近期发生的被认为与XMT-2056相关的5级(致命)严重不良事件(SAE)自愿暂停临床试验。SAE及其原因仍在调查中。
XMT-2056是Mersana首个进入临床的Immunosynthen STING激动剂ADC候选产品,SAE发生在第二名患者中,该患者在Phase 1试验剂量递增部分的初始剂量组,为HER2+复发性或转移性实体瘤患者。在临床试验期间,不会招募任何患者或对试验进行给药。

2022年8月8日,Mersana宣布与GSK就XMT-2056药物的共同开发和商业化达成选择许可协议。
根据协议,GSK获得XMT-2056的全球独家许可权,Mersana获得1亿美元预付期权购买费;如果GSK行使选择权,Mersana公司还有资格以选择权行使费和开发、监管和商业里程碑付款的形式获得最多13.6亿美元。
而就在该交易的发生第三天,我对该药物做出过简单评价,认为XMT-2056这个药本身成药性不强,但这个方向,依然觉得可以尝试。(曾经国外大厂的deal,一直是国内药企立项的风向标,现在来看,国外大厂眼光也未必精准。同时,在今日辉瑞以430亿美元的价格买下seagen,未必精明。)
XMT-2056这款激动型ADC,所选择的HER2抗体,是针对HER2抗原新表位,不同于曲妥珠和帕妥珠。这个思路是不错的,防止后续联用过程,出现相互之间的药物阻断情况。
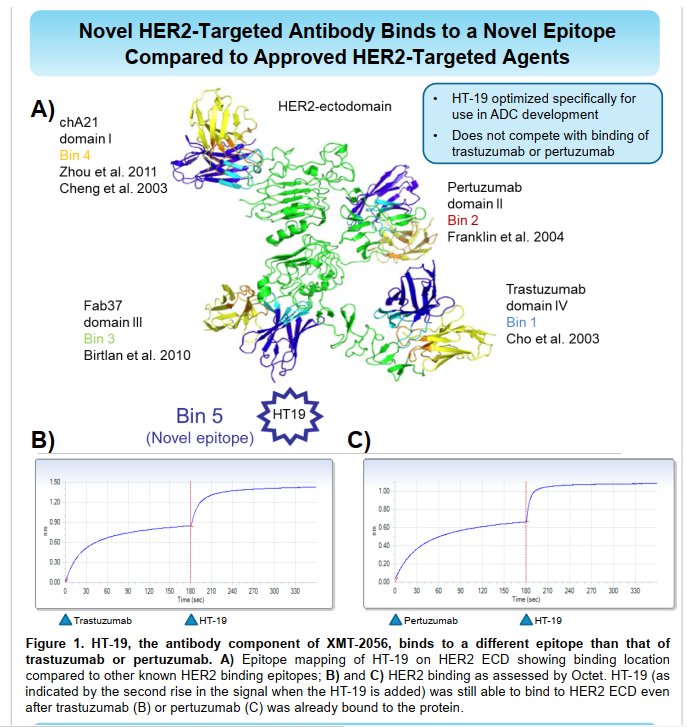
XMT-2056依赖肿瘤细胞靶向抗原刺激STING信号,以此来激活先天免疫系统,达到抗肿瘤的目的。

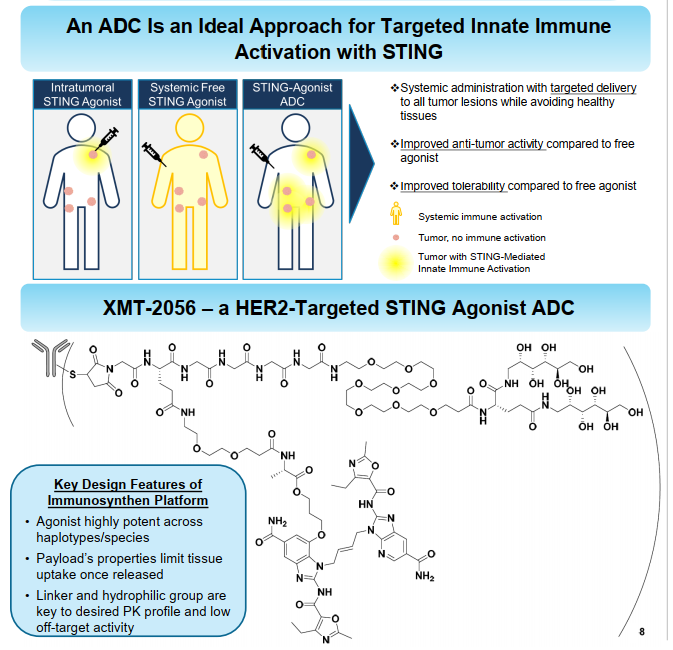
但payload活性太强,这在临床前的实验中就可以发现。
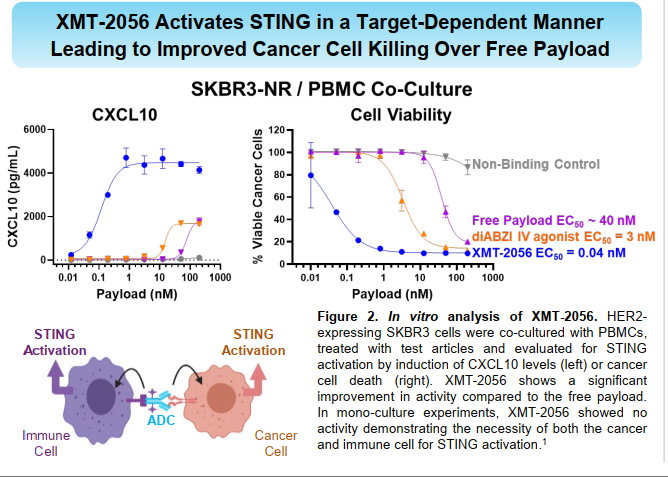
尤其在动物实验中,0.3mg/kg的药效就十分明显,1mg/kg已经是非常优异了。做过激动剂都了解,这东西跟杀伤性ADC很像,药效跟毒性成正相关,当初看到这个实验数据,我基本就断定这个药很难成了。
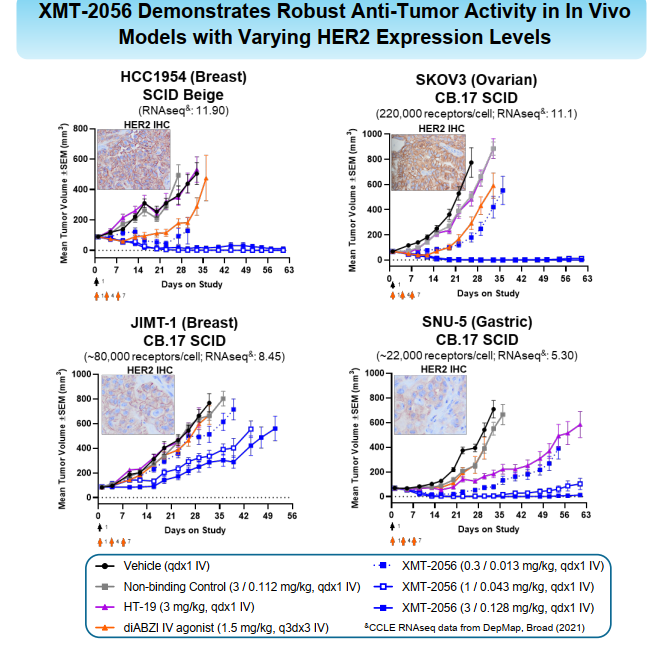
其它实验也同样明显。
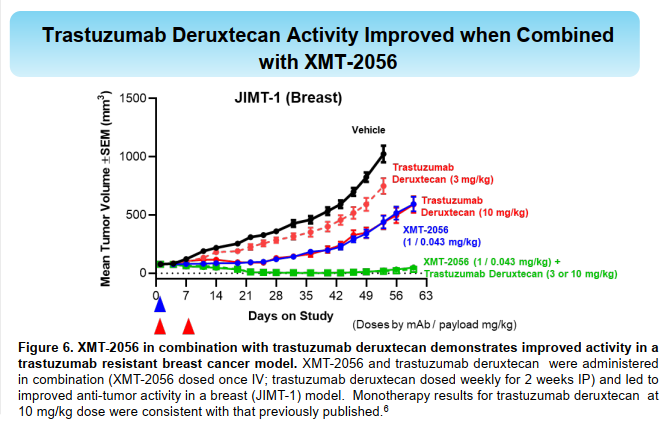
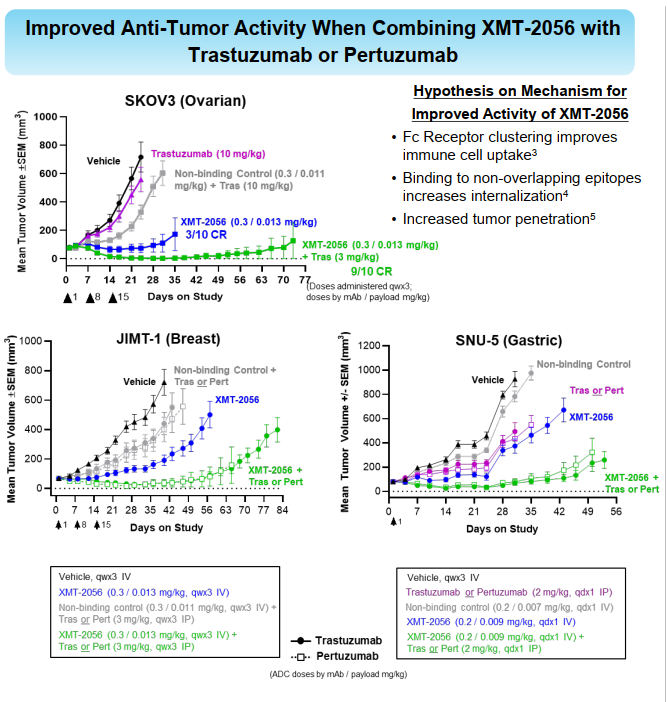
激动型ADC开发难度可能比杀伤性ADC更大,而且单独用药的情况下,临床前未必就一定会很好,而且需要良好的安全性窗口。在我看来用什么样的payload,TLR7/8,或者STING,其实都有成药的可能,关键是怎么把握payload的活性,以及未来临床的试验设计细节。
我依然看好这个领域的未来,道阻且长,需要我们慢慢地来。
文章来源:药智新闻
推荐内容: