近日,一则“关于加强药物临床试验机构日常监管的函”在网上流传,该函提及近期,国家局核查中心联合相关省局在组织开展药品注册现场核查中,发现上海市东方医院等13家临床试验机构在临床试验数据完整可靠方面存在问题。核查中心已将核查发现的问题告知被检查单位,并建议整改。该函还要求当地药监局监督相关机构在6个月内完成整改,整改到位并经确认后方可开展新的药物临床试验;可视情况运用告诫、约谈、警告等措施依法依规处理。
不过,该函的附件并没有一并流出。有自媒体文章对这13家医疗机构做了推测,但实际上除了东方医院,其他机构均未得到官方证实。

图片来源:GCP研究大汇微信公众号
笔者查询药物临床试验机构备案管理信息平台 (https://beian.cfdi.org.cn/CTMDS/apps/pub/drugPublic.jsp),发现该平台收录的全国1230家临床试验机构中,多家机构有监督检查整改记录。
目前显示仍在整改中的机构有数十家(表1截取了部分监督检查信息,供大家参考)。不过,从查询的结果来看,无法判断本次发函的机构是哪13家。另外,有被要求整改的记录,不代表该机构目前仍然还处于被整改中,具体情况可咨询当事机构。
表1. 部分监督检查信息汇总
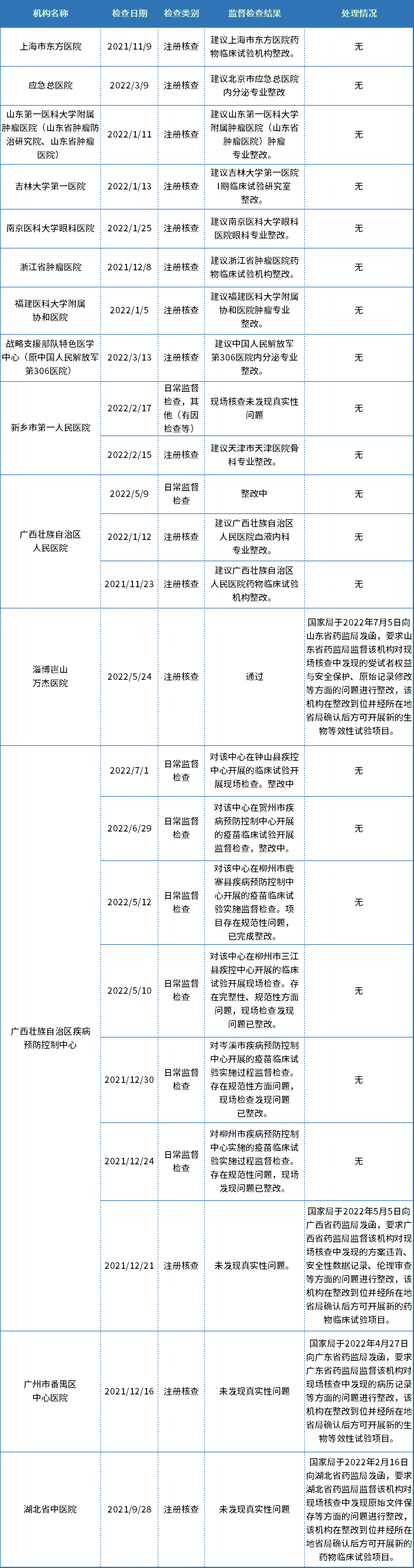
数据来源:药物临床试验机构备案管理信息平台
而近两年,国家药监局已多次发布“关于加强药物临床试验机构日常监管的函”,要求当地药监局监督医疗机构对现场核查中的问题进行整改,该机构在整改到位并经所在地省局确认后方可开展新的临床试验、生物等效性项目。
此次流传的函并无特别,是一份正常的函。
但全国各药物临床试验机构的监督检查情况确实需要大家时时关注。临床试验水平对制药行业的发展有至关重要的影响。与创新药的发展一样,我国临床试验发展也还处在不断规范中。
1997年,专家组起草了第一个中国特色的GCP草案。经过业界的征询补充,1998年3月2日,中国卫生部颁布了第一版《药品临床试验管理规范GCP》(试行)。此后,1999年、2003年又分别颁布了第二版和第三版GCP。
2015年7月22日发布《关于开展药物临床试验数据自查核查工作的公告》,核心内容就是临床试验的真实性和科学性,要求申办方自查1622个审评中的申请药物,如果申办方自己认为缺乏规范性或认为自己有不足,主动撤回申请,这样不追究任何问题,不受任何惩罚,并且可以重新补充再申报。这个措施让其中的1210个试验主动撤回,是业内的一个里程碑事件,为中国临床试验质量的提高奠定了常态持久的发展基础。
此后,中国GCP参照ICH-GCP的内容,于2020年7月1日国家药品监督管理局(NMPA)、国家卫生健康委员会(NHC)联合颁布第四版GCP,法规上实现了与国际接轨。
在一系列政策和资本的助推下,我国药物临床试验迅速发展,根据CDE药物临床试验登记平台公示的数据统计,截至2021年底,我国药物临床试验登记合计高达15604项,其中2021年就有3290项。
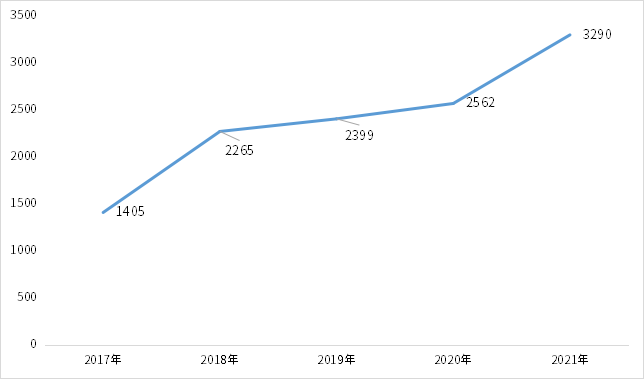
2017-2021年药物临床试验登记趋势_按登记号计
数据来源:药智数据
爆发式增长的药物临床试验需求也对临床试验机构也提出了挑战。
例如,符合要求药物临床试验机构较少,不过近几年这一问题已得到解决。2019年12月1日,《国家药品监督管理局国家卫生健康委员会关于发布药物临床试验机构管理规定的公告》(2019年第101号)实行临床试验机构备案管理。截至目前,在药物临床试验机构备案管理信息平台备案的全国临床试验机构共1230家。
但新的问题又开始出现。例如今年2月,美国食品药品管理局(FDA)在针对信达医药的信迪利单抗开展专家审评会上,对中国患者临床试验数据的真实性提出质疑。
这种对中国临床试验不信任的刻板印象还需要全医药行业共同努力,持续提升临床试验质量才能得到认可。相信在监管机构一系列“注册核查”、“有因检查”和“日常监督检查”中,中国临床试验机构管理水平将得到不断提升,临床试验质量也将大幅提升。
文章来源:药智新闻
参考来源:
1. https://beian.cfdi.org.cn/CTMDS/apps/pub/drugPublic.jsp
2. 中国新药临床试验:轰轰烈烈背后的 “巨婴” 业务
3. 中国临床试验又迎来“整风”运动!
推荐阅读:
如果不想年纪大了记不住人,请先做好这3件事,“远离”老年痴呆
异维A酸让油腻的皮肤变清爽,一步到位?服用前要知道这些(上)
异维A酸让油腻的皮肤变清爽,一步到位?服用前要知道这些(下)