导读:全球细胞治疗迅猛发展~
近日,Technology Networks 网站发文总结了目前细胞疗法的五大创新,其中包括CAR-T细胞疗法,T细胞受体工程化T细胞疗法(TCR-T),间充质干细胞疗法,第二代干细胞疗法等。
本文将其进行编译整理,供大家学习交流。


近几十年,细胞疗法取得了飞速的发展,从最初将人类干细胞用于血液系统癌症的治疗,到2017年,第一个CAR-T疗法——tisagelecleucel(Kymriah)获得批准。现在,有许多不同类型的基于细胞的疗法正在被开发,仅针对癌症就有2000多种正在开发中。
1、CAR-T免疫细胞疗法
在过去,CAR-T细胞疗法主要是利用患者自身的T细胞,在体外改造后可带上精准定位肿瘤细胞的抗体,然后回输到患者体内,用于识别和攻击肿瘤。这种方式依赖于使用患者自身的T细胞,可以防止宿主免疫系统的排斥。
但这种方法需要大量时间对T细胞进行改造,很难标准化,并且很难进行多次给药。因此,研究人员正在努力开发“现货型”CAR-T细胞,可以使CAR-T细胞针对多种肿瘤抗原进行工程改造,并通过使用工业化工艺扩大生产来减少时间和成本。
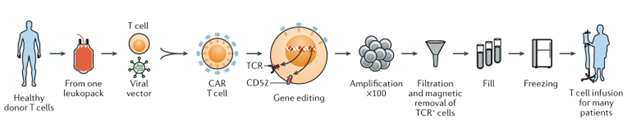
图片来自文献[2]
2、实体瘤的CAR-T细胞疗法
CAR-T细胞疗法已经在血液系统肿瘤治疗中取得巨大突破,然而,CAR-T细胞治疗实体肿瘤并不像血液系统肿瘤那么顺利。
简单来说,CAR-T细胞如何识别实体肿瘤,如何渗透入实体肿瘤内,如何在实体肿瘤中生存并起作用等,这些方面存在很大的挑战。
首先,要寻找到CAR-T细胞用于实体瘤治疗的新的靶抗原,目前有一系列不同的抗原正在被探索用于实体瘤。
此外,除了选择正确的抗原,CAR-T细胞疗法必须在更为复杂的肿瘤微环境中工作,其中包括纤维化组织和失调的血管等物理屏障,以及抑制性细胞和细胞因子的免疫抑制。
为了避免这种情况,新的CAR-T细胞被改造以表达免疫刺激趋化因子或促纤维化生长因子的抑制剂,以此获得在复杂肿瘤微环境中生存的能力。
3、TCR-T免疫细胞疗法
T细胞受体工程化T细胞疗法与CAR-T细胞疗法一样,都涉及T细胞表面的抗体改造,但在CAR-T细胞中,T细胞被改造成能识别肿瘤细胞上天然存在的某种抗原。而TCR-T疗法被工程化以识别不同类型的抗原。
在TCR治疗中,T细胞表面受体与蛋白质连接,蛋白质用于标记靶细胞,以提供信号以供免疫系统进行攻击。
这种方法最近被用于靶向具有KRAS基因突变的癌细胞,该基因长期以来被认为是“不可追踪”的靶点。然而,研究发现具有KRAS突变的胰腺癌患者在其肿瘤细胞上表达特定类型的人类白细胞抗原。这促使研究人员测试针对特定KRAS突变的T细胞受体是否能调动免疫系统对抗肿瘤细胞。
在一项研究中[3],科学家们利用改造成识别KRAS的T细胞,经此治疗后完全根除了小鼠模型身上的肿瘤。基于这些发现,这种治疗现在将于2022年进入晚期胰腺癌患者的临床试验,该胰腺癌携带KRAS突变。
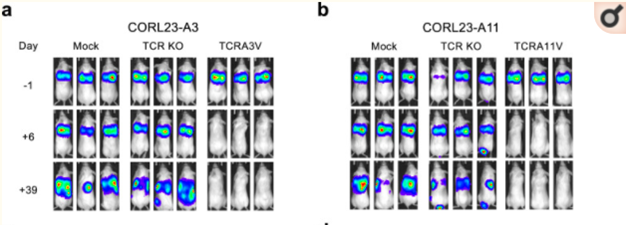
图片来自文献[3]
4、间充质干细胞疗法
间充质干细胞(MSCs)存在于骨髓、脂肪、脐带、胎盘等在内的各种组织中。从美国国立卫生研究院的最大临床试验注册库http://clinicaltrials.gov网站上了解到,目前有1300多项有关间充质干细胞的临床试验正在开展。

迄今已经有一些基于MSCs的疗法获得批准上市:包括用于移植物抗宿主病和克罗恩病的治疗。
最近,研究又拓展了间充质干细胞的适应症:可以帮助增强机体对艾滋病毒的免疫力,并恢复其造成的损害[4],这给艾滋病的治疗增添了新武器。
当研究人员将取自恒河猴骨髓的间充质干细胞输注给患有艾滋病的猕猴时,他们看到了立竿见影的效果——包括抗艾滋病毒抗体和T细胞的增加,以及肠道淋巴滤泡的恢复。当间充质干细胞与抗逆转录病毒药物联合使用时,能够为艾滋病毒感染者提供多管齐下的治疗策略。
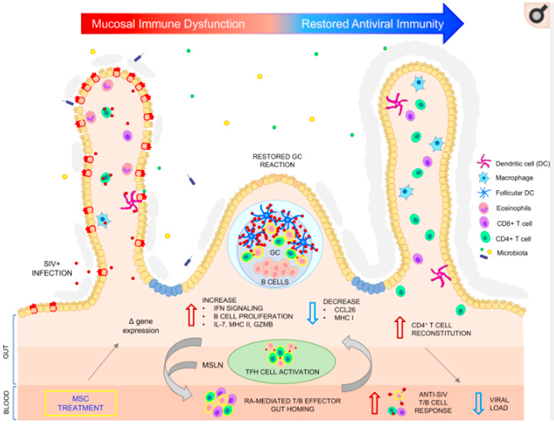
图片来自文献[4]
5、第二代干细胞疗法
造血干细胞和间充质干细胞被称为第一代干细胞。现在,从多能干细胞(PSCs)衍生而来的第二代干细胞疗法—人类胚胎干细胞(hESCs)和诱导多能干细胞(iPSCs)。也被广泛研究。这些干细胞可以在体外无限扩增,并具有多向分化能力,有可能产生体内的任意一种细胞类型。
由于上述优势,hESCs和iPSCs目前正在被研究用于建立人类疾病的体外模型和用于工程化生产人类细胞和组织以替代患病或受损的结构和器官。在一项动物试验中[5],低免疫源性多能干细胞衍生而来的的心脏、肌肉和肺内皮细胞可以在免疫活性正常的小鼠中存活并成功治疗疾病,这表明该疗法可避免传统器官移植造成的免疫排斥问题,是干细胞研究领域的重大突破。
目前,hESCs和iPSCs主要用于基础研究领域。对于胚胎干细胞输入体内后如何控制其生长分化 ,如何提高临床的安全性,还缺乏全面可靠的资料,同时临床应用还将面临伦理争议的问题;而对于诱导多能干细胞,人们尚缺乏对细胞转化机理的了解,在临床安全性等方面仍然存在挑战。
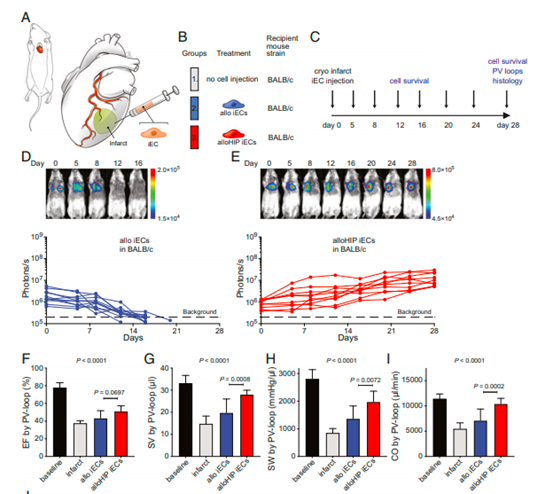
图片来自文献[5]
6、展望
如今,细胞疗法可谓大放异彩,CRISPR等基因编辑技术的出现,加上人们对免疫学理解的加深,以及对培养、制造、运输、储存和处理专门生物样品和材料的优化,细胞治疗领域正在发生革命性转变。
从第一次干细胞移植到今天工程细胞疗法获得批准,花费了近50年的时间,但相信随着研究的加快推进,人们能在更短时间内看到下一代基于细胞的治疗惠及更多的患者。
参考文献:
[1]https://go.technologynetworks.com/five-innovations-in-cell-based-therapy.
[2]Depil S, Duchateau P, Grupp SA, Mufti G, Poirot L. 'Off-the-shelf' allogeneic CAR T cells: development and challenges. Nat Rev Drug Discov. 2020 Mar;19(3):185-199.
https://pubmed.ncbi.nlm.nih.gov/31900462/
[3] Bear AS, Blanchard T, Cesare J, Ford MJ, Richman LP, Xu C, Baroja ML, McCuaig S, Costeas C, Gabunia K, Scholler J, Posey AD Jr, O'Hara MH, Smole A, Powell DJ Jr, Garcia BA, Vonderheide RH, Linette GP, Carreno BM. Biochemical and functional characterization of mutant KRAS epitopes validates this oncoprotein for immunological targeting. Nat Commun. 2021 Jul 16;12(1):4365.
https://pubmed.ncbi.nlm.nih.gov/34272369/
[4] Weber MG, Walters-Laird CJ, Kol A, Santos Rocha C, Hirao LA, Mende A, Balan B, Arredondo J, Elizaldi SR, Iyer SS, Tarantal AF, Dandekar S. Gut germinal center regeneration and enhanced antiviral immunity by mesenchymal stem/stromal cells in SIV infection. JCI Insight. 2021 Jun 22;6(12):e149033.
https://pubmed.ncbi.nlm.nih.gov/34014838/
[5] Deuse T, Tediashvili G, Hu X, Gravina A, Tamenang A, Wang D, Connolly A, Mueller C, Mallavia B, Looney MR, Alawi M, Lanier LL, Schrepfer S. Hypoimmune induced pluripotent stem cell-derived cell therapeutics treat cardiovascular and pulmonary diseases in immunocompetent allogeneic mice. Proc Natl Acad Sci U S A. 2021 Jul 13;118(28):e2022091118.
https://pubmed.ncbi.nlm.nih.gov/34244428/
推荐阅读: