2020年注定是不同寻常的一年,新冠疫情肆虐导致多个产业发展出现停顿和衰退,但全球药物研发管线并没有出现萎缩,企业申报药品临床试验和生产/上市的热情也未曾减弱。
全球研发药品数量增势不减
根据新药研发监测数据库(CPM)显示,从2020年度全球药品研发数据看,排除已申报但目前处于排队等候或已暂停、终止阶段的药品研究,全球处于活跃研究状态的在研药物共1427例,获批上市药物共150例,两类药物数字均再创历年新高,总体呈现持续增长之势。可见尽管疫情当道,全球医药产业的研发动力仍然十分充沛。
(活跃研究状态指于2020年获批I期、II期、III期临床试验)
图1 2016-2020年全球活跃在研及批准上市药物数对比

来源:新药研发监测数据库(CPM)
创新企业高度集中,中国占比进一步扩大
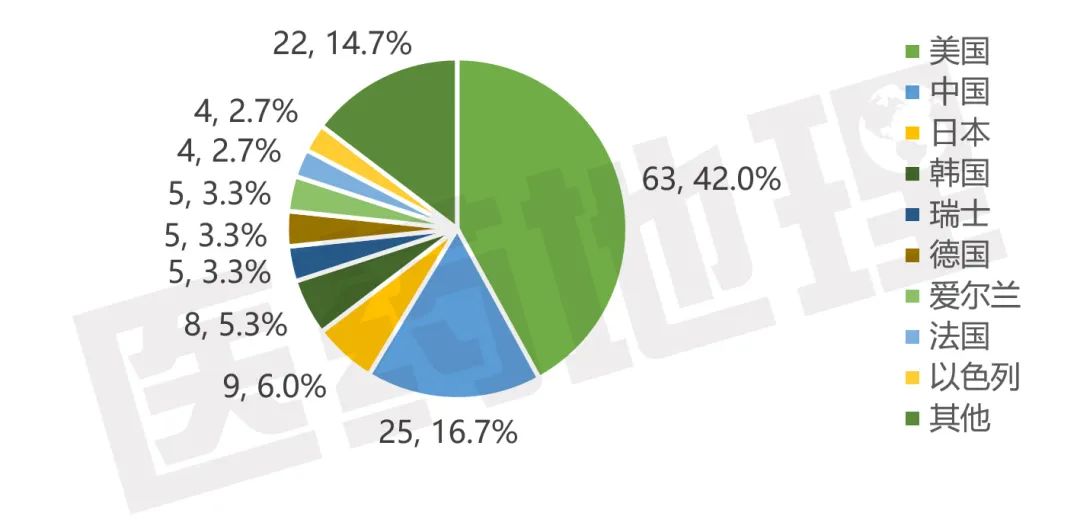
从原研企业所属国家看,2020年拥有获批各阶段临床药物的企业总部所在地位于32个国家或地区、拥有获批上市药物的企业来自19个国家或地区。主要集中在中美两国,其次是日本、韩国以及欧盟等国;中国企业获批各阶段临床的企业占比为19.6%,较上年增长4.3个百分点,获批上市的企业占比为16.7%,较上年增长7.2个百分点,发展态势良好。
图22020年拥有获批活跃在研药物企业所属国家及地区分布

图32020年拥有获批上市药物企业所属国家及地区分布
来源:新药研发监测数据库(CPM)
国内各类药品注册申报数量再创新高
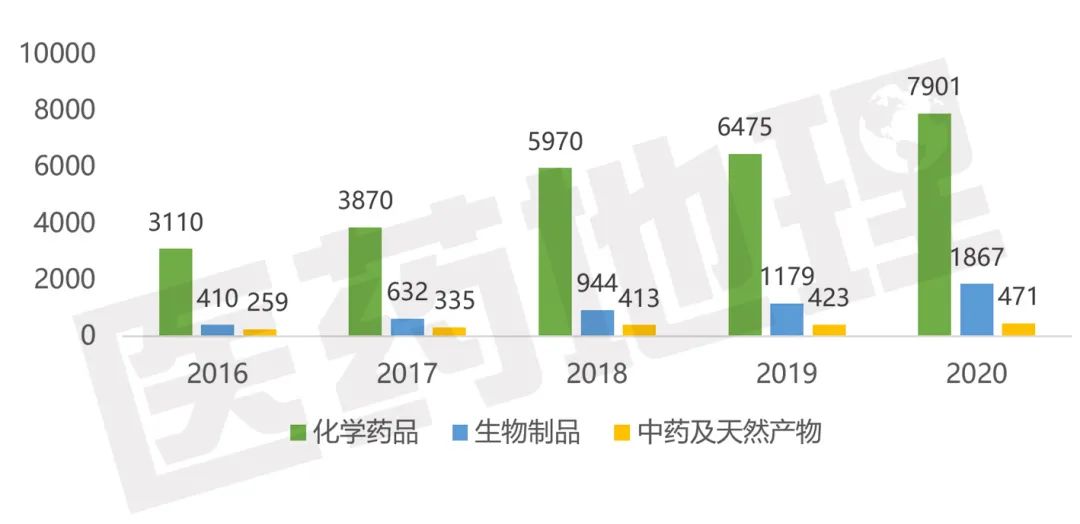
聚焦中国市场。2020年国家药品审评中心共受理各类药品新注册申报10239件,注册申请数量持续攀升,较2019年同比增长了26.8%。总体上,2020年的药品注册申报主要集中在化学药品领域,注册申请受理量为7901件,较2019年增长22.0%,占比达到77.2%,其次是生物制品1867件,较2019年增长58.4%,占比为18.2%,最后为中药及天然产物共471件,较2019年增长11.3%,占比为4.6%。从生物制品超50%的增加量可以看出,由于全球新冠疫情的影响,我国医药产业进一步加大了对生物制品领域的关注和投入,尤其新冠病毒疫苗和新冠肺炎治疗有关药物,为新冠肺炎的防治提供了有力支持。
图4 2013-2020年CDE受理药品注册申请件数
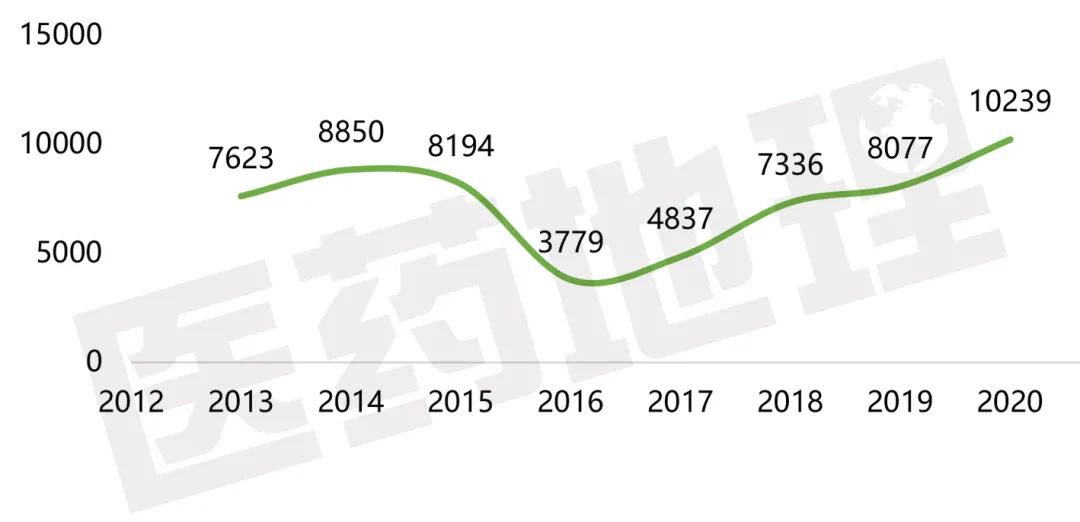
图5 2016-2020年CDE受理注册申请药品类型分布
来源:CDE《2020年度药品审评报告》
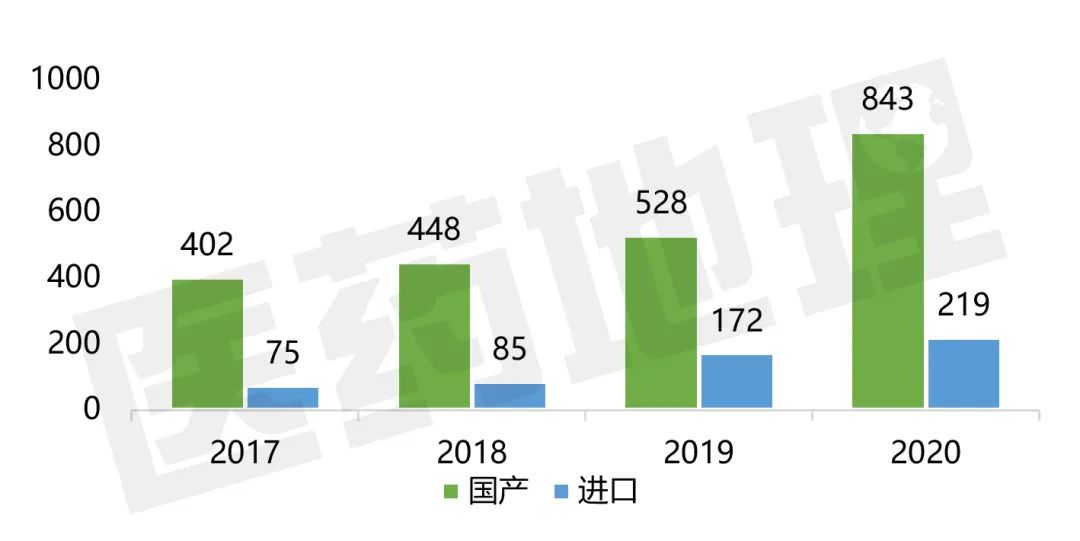
关注国内创新药品。在以生产场地统计时,境内生产的1类创新药共有843件,境外生产的则有219件。与往年相比,国产1类创新药增速为59.7%,对比进口1类创新药,大致为其增速27.3%的两倍。该情况反映出,面对不断侵袭的新冠疫情,国产1类创新药品注册申报数量仍在大幅度提升,表明国内企业正努力甩开环境影响,艰难中不断增强自身创新能力和综合实力,希望国内企业能保持这一良好势头,持续稳健发展。
图6 2017-2020年境内、外生产的1类创新药受理情况
来源:CDE《2020年度药品审评报告》
国内创新药获批上市进程再攀新峰
在新药审评审批不断提速,新药创制重大专项、国家重点研发计划等政策的扶持下,一批具有明显临床价值、满足临床急需的新药好药在全球率先获批上市,进一步满足了公众的临床急需。2020年度药审报告中,审评通过NDA上市申请共208件,较2019年增长26.8%,具体而言,审评通过化学药NDA申请115件,较2019年增长30.7%;审评通过中药NDA申请4件,较2019年增长100%;审评通过生物制品NDA申请89件,较2019年增长20.3%。
图7 2020年各类药品NDA申请审评通过情况

来源:CDE《2020年度药品审评报告》
创新药方面,2020年审评通过20个品种的创新药新药上市申请,包括1类化学药14个、中药创新药4个、创新生物制品2个,具体品种见下表1。药品审评审批制度改革以来,新药上市进程在2020年达到了新巅峰。2019年创新药新药上市申请通过品种仅为10个,一年时间,这一数字翻了整整一倍。
表1 2020年药审中心审评通过的创新药名单
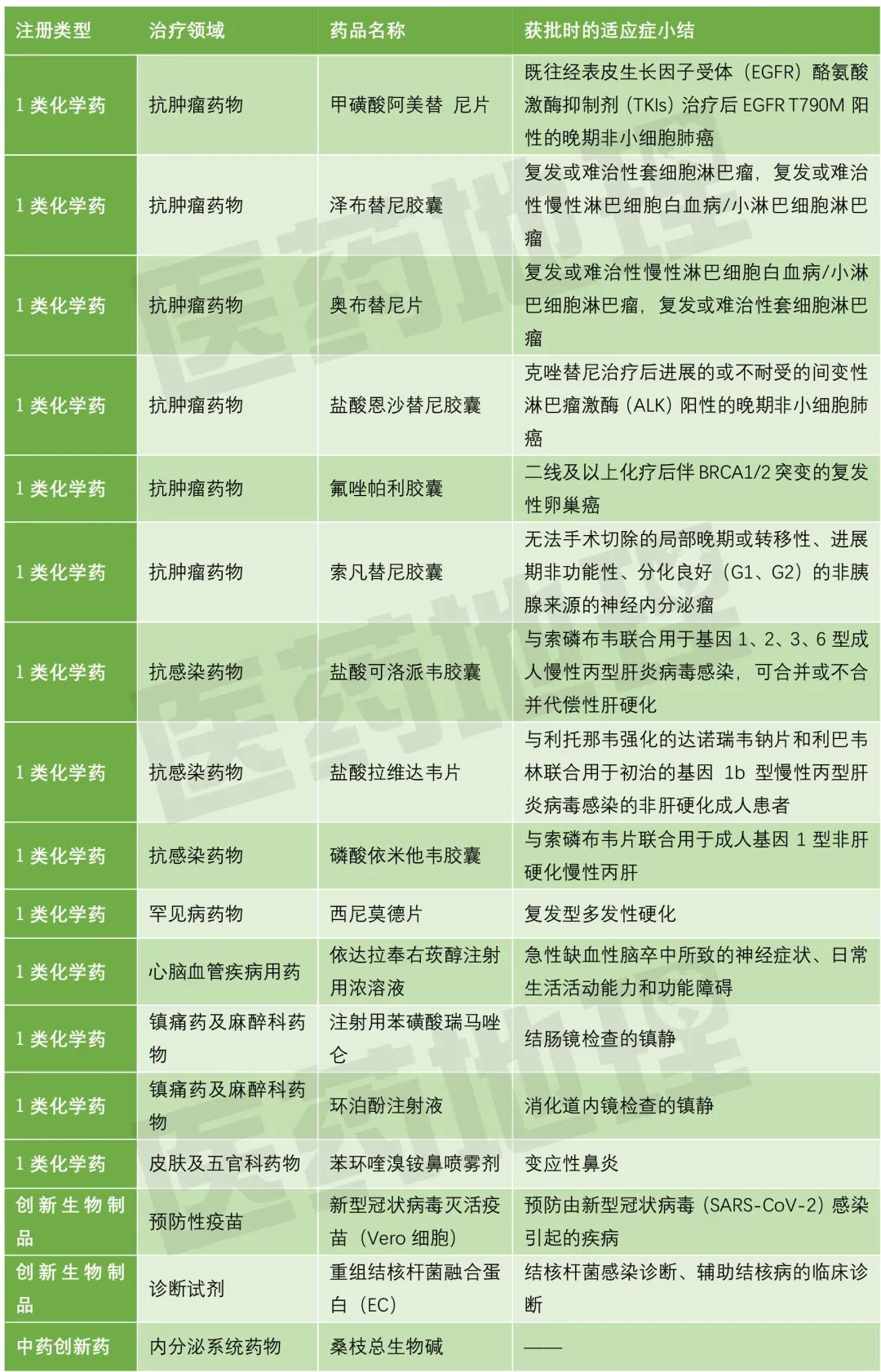
来源:CDE《2020年度药品审评报告》
虽然目前创新药在中国医药市场上占的市场份额较小,仿制药依旧占据最大的市场,但从监管、研发和资本投入等多个方向来看,创新药毫无疑问是未来医疗市场最坚定的方向之一。
未来,随着政策的推动、技术的发展以及研发费用的持续投入,创新药市场份额必将得到进一步提升,中国的创新药时代势必席卷而来!
推荐阅读:
271个药通过新版医保初审,含阿齐沙坦片,这是最好的降压药吗?
治疗心力衰就的药物地高辛,有毒性吗?地高辛的不良作用是什么?
卡维地洛成唯一治疗心力衰竭的药,心力衰竭为何能用β受体阻滞剂?