日前,生物医药行业知名媒体Fierce Biotech发布了2022 Fierce 15榜单,入选的公司多达半数为核酸治疗领域新锐。
什么是核酸药物?
简单来说,核酸药物是指核苷酸形成的有医学作用的大分子。
具体来讲,核酸药物包括反义寡核苷酸药物 (ASO)、小干扰RNA (siRNA)、核酸适配体药物(aptamer)、信使RNA (mRNA)等。其中在新冠肺炎防治中大放异彩的mRNA新冠疫苗即是核酸药物的一种。
新药研发的另一种可能——核酸药物
核酸类药物发展可以追溯到20世纪50年代。1956年,生物物理学家Alexander Rich发现两条单链的RNA是可以像DNA那样结合(base pair)在一起形成双链。随后的20多年里,一系列关于RNA的功能陆续解密。
1998年,首个ASO药物Vitravene (Fomivirsen)获批上市,该药由Ionis研发,用于治疗HIV患者的眼部CMV病毒感染。2004年,首个RNA 适配体药物Macugen (pegaptanib)获批上市,该药由辉瑞和Eyetech联合开发,用于治疗wAMD。2018年,首个siRNA药物Onpattro (patisiran)获批上市,该药由Alnylam开发,用于治疗hATTR。
2020年,新冠疫情加速mRNA药物上市,目前全球已有 2 款新冠 mRNA 疫苗获批上市,分别为 BioNTech 和辉瑞共同研发的Comirnaty(BNT162b2)以及 Moderna 研发的 Spikevax(mRNA-1273)。
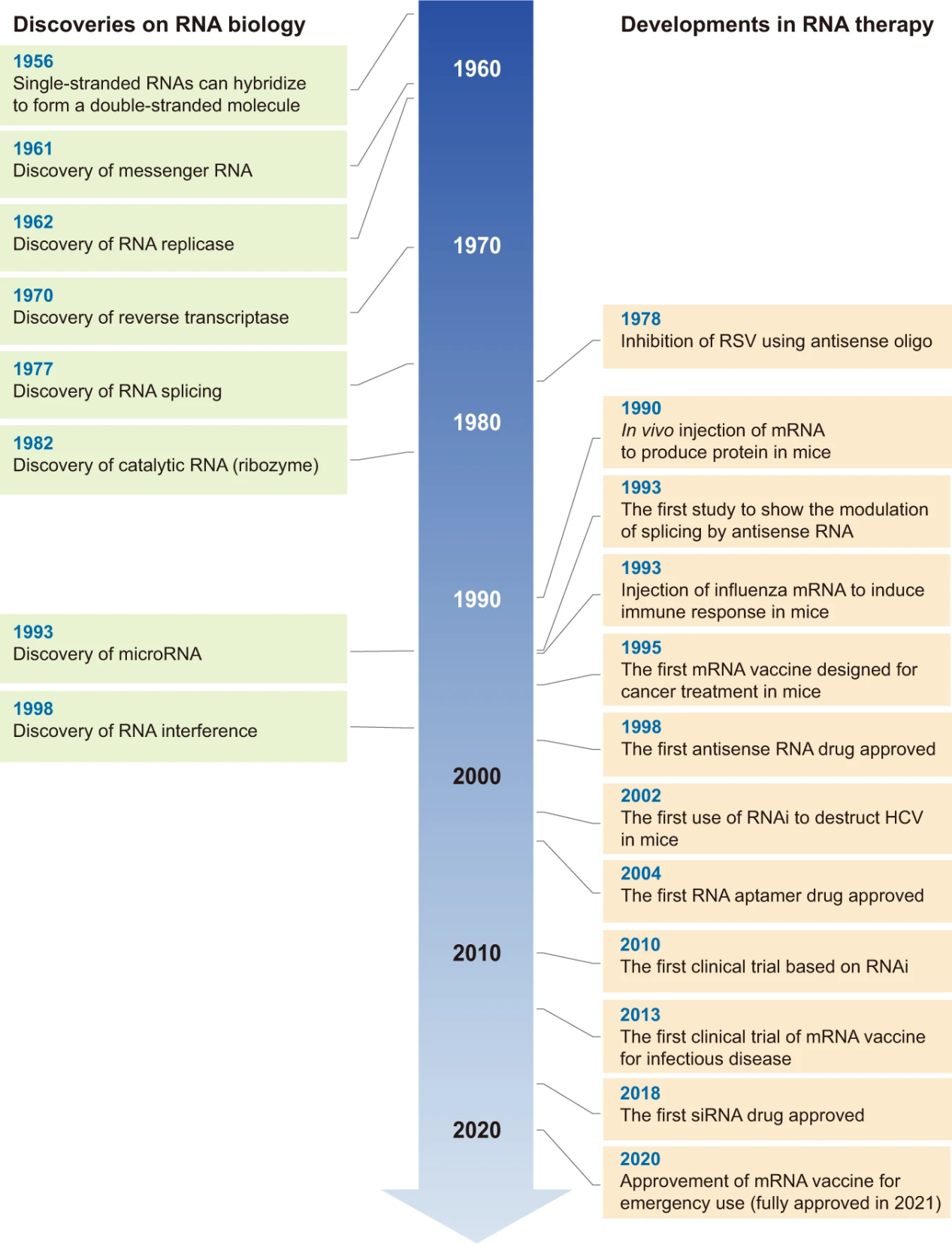
图1. RNA的重大发现和治疗的关键进展时间表
图片来源:参考资料1
随着递送技术和 RNA 药物形式的多样化发展,核酸药物已经开启繁荣发展的时代,也被称为继化学药、抗体药后的第 3 代药物。与传统的化学治疗药物相比,核酸药物优势显著:
靶向“不可成药”靶标。核酸药物的靶标可以是细胞内几乎任何基因成分,包括许多小分子和抗体药物无法靶向的靶点。
快速生产。开发生产新型小分子或抗体药物可能需要数年时间。然而,一旦确定了RNA的化学结构和递送到体内的途径,就可以快速设计和合成RNA药物用于临床试验。BioNTech/辉瑞和Moderna的mRNA新冠疫苗就是很好的例子。
具有长效性。虽然天然RNA很容易被天然核酸酶降解,但当对其合成进行各种修改时,RNA的稳定性会大大提高。例如2021年获批的siRNA药物inclisiran的沉默效果能在单次注射后持续六个月以上。
用于罕见病治疗。制药公司往往不愿为非常罕见的疾病生产新药,因为潜在利润有限。然而,在就RNA疗法而言,一旦RNA的化学成分及其传递系统得到优化,开发这些药物的新变种用于新疾病的成本就会大大降低。
截至目前,美国FDA已经批准了9个ASO,4个siRNA,1个aptamer,和2个mRNA新冠疫苗,还有上百个正在临床研究的候选产品。
美国FDA批准的核酸药物
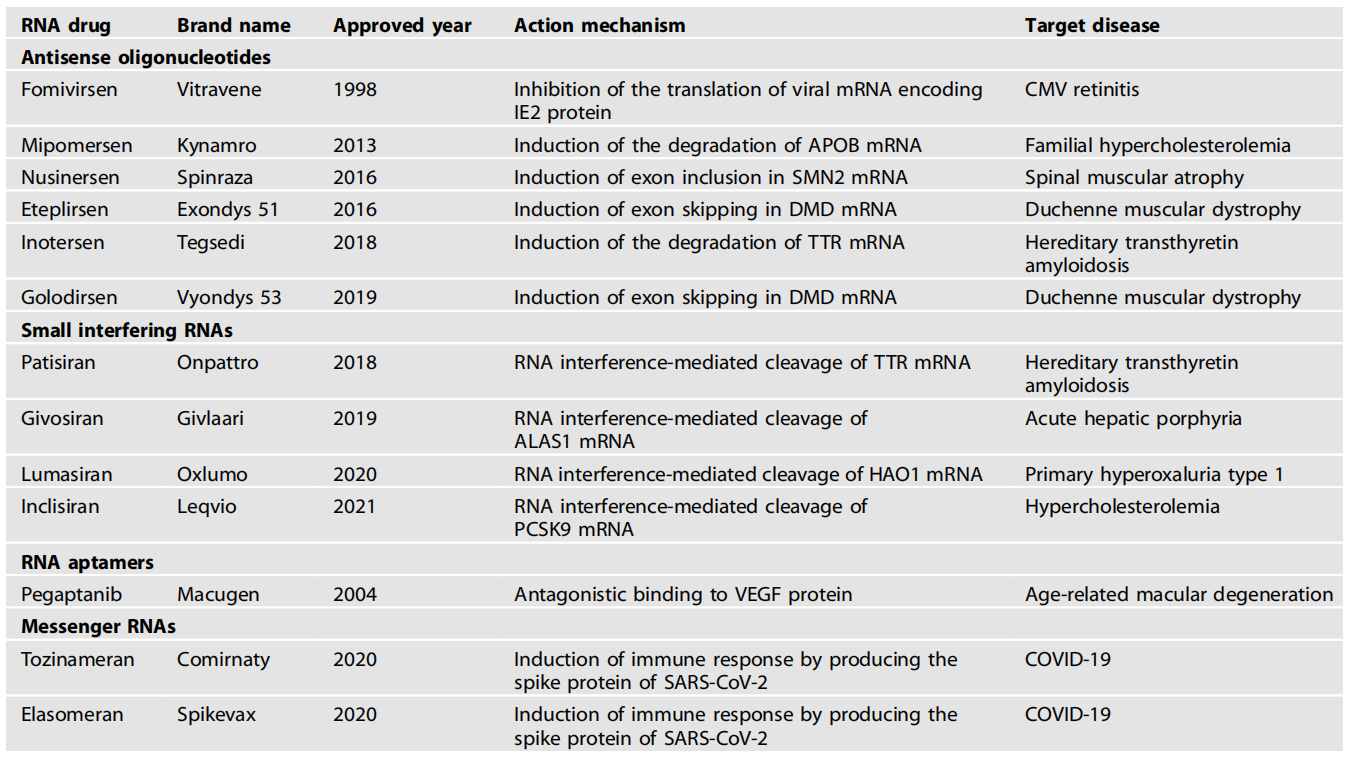
图片来源:参考资料1
反义寡核苷酸药物 (ASO)
ASO是发展最早、获批药物最多的核酸药物。
ASO通过结合到特异性序列以调节靶RNA的表达,尽管这些反义寡核苷酸的结构主要由它们的特定序列决定,但它们的化学性质可以被调节修饰以促进其特异性和稳定性。首个获批的ASO药物是Ionis的Vitravene (Fomivirsen),用于治疗巨细胞病毒性视网膜炎,特别适用于合并感染人类免疫缺陷病毒(HIV)的患者,于 1998 年获批上市,其机制为与CMV 复制所必需的 immediate-early-2(IE-2)蛋白的mRNA 结合,从而抑制CMV 复制。然而,该药在2001年被FDA撤回,因为用于HIV患者的抗逆转录病毒疗法显著减少了对 Viteavene的需求。
真正意义上的被FDA 批准的、基于反义结合原理抑制细胞内mRNA 表达的ASO 药物是Mipomersen,于2013年在美国获批上市。该药是由法国赛诺菲旗下的健赞公司开发,用于治疗遗传性胆固醇代谢紊乱的药物。
目前,已被美国FDA批准的ASO药物还有mipomersen、inotersen、nusinersen、eteplirsen、golodirsen、volanesorsen、viltolarsen、casimersen。
其中用于治疗脊髓性肌萎缩症的nusinersen (Spinraza, 诺西那生钠) 在2019年销售额达到20.97亿美元,成为小核酸药物领域首款“重磅炸弹”。该药已在国内作为孤儿药上市,且在2021年通过国家医保药品目录谈判,成功被纳入医保目录。
除了这些已获批准的药物外,目前还有数十款ASO药物处于临床研究阶段,治疗领域覆盖中枢神经系统、心血管、抗感染和肿瘤等。
小干扰 RNA (siRNA)
siRNA也被称为沉默RNA、短干扰RNA或非编码RNA。siRNA使用内源性RNA干扰途径来调节其靶RNA的表达,由于其特异性、适应性和广泛的靶向能力,它在多种疾病的个性化基因治疗中也很有效。siRNA的发现在2006年获得了诺贝尔生理医学奖。
然而,裸siRNA在血流中不稳定,除了具有免疫原性外,还不能有效地穿过细胞膜。因此,精确设计递送系统对于充分发挥这种疗法的潜力至关重要。
随着RNA干扰递送方法的持续创新,2018年,全球首款siRNA药物patisiran终于获批上市,该药通过新型脂质纳米颗粒(Lipid Nanoparticle, LNP)技术包裹递送到肝脏,用于治疗遗传性甲状腺素介导的淀粉样变性的多发性神经病。
目前,已有4款siRNA的药物已被美国FDA批准,即patisiran、givosiran、lumasiran和inclisiran。
核酸适配体药物
适配体是设计用于结合特定蛋白质以调节其功能的核酸构建体。目前,只有一种基于RNA的适配体药物获得美国FDA的批准。
Pegaptanib 是一种28个核苷酸的构建体,被批准用于湿型(新生血管性)年龄相关性黄斑变性 (AMD) 的治疗剂。目前还有几种RNA适配体正在开发中,预计未来将出现治疗其他疾病的RNA适配体。
信使RNA (mRNA) 药物
mRNA是一种单链长核糖核酸,能够传递DNA中的遗传信息,经过翻译合成蛋白质。mRNA进入体内后,可以由自体细胞表达出特定的蛋白质,避免了体外因素影响;可以通过内源表达功能蛋白调节人体免疫系统,并消除包括癌细胞在内的自体威胁。mRNA产品具体又可分为mRNA疫苗和mRNA药物。
mRNA疫苗:直接翻译含有编码抗原蛋白的mRNA。编码抗原序列的mRNA疫苗通过脂质纳米载体等递送平台被引入细胞,然后由人体细胞通过翻译产生抗原,激活免疫反应。与传统疫苗相比,mRNA疫苗通过内源性表达抗原蛋白,可以诱导更为广泛有效的细胞免疫及体液免疫反应,产生更高的保护率。
2020年,两款基于mRNA的新冠肺炎疫苗在世界大多数国家获得了批准,其效用已在大流行中得到了充分的证明。除了作为预防性疫苗,mRNA疫苗也可用作针对特定肿瘤的个性化药物。
全球部分 mRNA 疫苗公司的研发管线布局概览
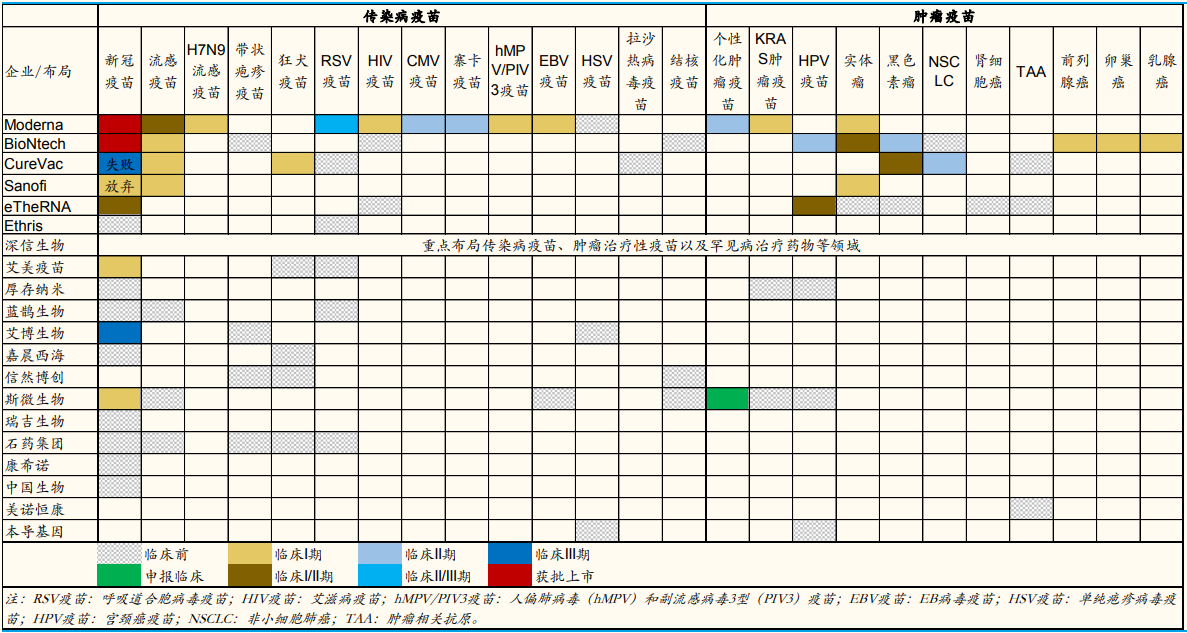
图片来源:公司公告,公司官网,国金证券研究所
mRNA药物:可作为蛋白质补充或替代疗法。mRNA不仅可以作为疫苗发挥作用,mRNA药物替代疗法也是主要的mRNA治疗方式之一。通过体外合成mRNA序列,再由递送系统递送到细胞内,向患者注射mRNA可以在病人自己的细胞中启动药物的生产,补偿有缺陷的基因/蛋白质,可以mRNA平台形式转化各种蛋白质药物,如单克隆抗体、酶和细胞因子等,并用来治疗代谢疾病、心脏病和免疫肿瘤学等多种疾病。
核酸药物站上风口
2020年新冠疫情暴发后,mRNA 疫苗的成功展现了核酸药物的巨大潜能,迅速成为新药研发市场的热点。
受国外成功案例的鼓励,我国核酸药物产业也得到快速发展。在mRNA 疫苗赛道上,艾博生物、斯微生物、蓝鹊生物、康希诺、石药集团等企业均在加速产品研发,目前已有十多款 mRNA 疫苗进入临床试验阶段。在小核酸药物赛道上,圣诺制药成功登陆港交所,其核心产品STP705正在中美开展临床研究;瑞博生物也已将两款 siRNA药物推向临床研究阶段:RBD7022和RBD1016;星曜坤泽的siRNA药物HT-101已提交临床试验申请。
当然,作为一项新的生物技术产品,核酸药物仍面临众多挑战,例如递送系统仍然是这类疗法面临的最大挑战之一。而概念还相对较新的mRNA 疗法则更是面临着半衰期短、mRNA 免疫原性风险、最大化蛋白质表达、mRNA 的递送等问题。此外,核酸药物的定价问题、副作用风险也值得注意。
技术的不成熟既提示着风险也代表着机会。相信随着技术的进步,核酸药物将得到更多样化的发展,为人类治愈疾病带来希望。
参考资料:
1. RNA therapy: rich history, various applications and unlimited future prospects.
2. 核酸药物的研发现状与应用前景展望.CNKI.
3. 商业化时代来临,mRNA 技术有望迎来黄金十年. 中泰证券
4. 核酸疫苗,创新未来. 国金证券
推荐内容:
肝硬化是肝炎的问题吗?越来越多人患有肝硬化,与这五点原因脱离不了关系!
糖尿病患者的福音,屠呦呦的“天然药”,青蒿素也能治疗心脏病?
心脏备用小马达:心脏起搏器医保报销吗?起搏器的手术费用是多少?
皮肤瘙痒、水泡、红斑、肿胀、死皮,湿疹用什么药好得最快最有效