急性髓细胞白血病简介:急性髓细胞白血病(acute myelocytic leukemia,AML) 或急性非淋巴细胞白血病(ANLL)包括所有非淋巴细胞来源的急性白血病。
- 发病部位
- 传染性
- 治愈率
- 多发人群
- 相关症状
- 并发疾病
- 急非淋,急粒,急性非淋巴细胞白血病,急性髓细胞性白血病
- 骨髓 血液血管
- 无传染性
- 40%
- 随年龄增长发病率升高
- 凝血障碍,骨溶解,白细胞减少
- 中枢神经系统白血病
- 挂号科室
- 治疗方法
- 治疗周期
- 治疗费用
- 临床检查
- 无
- 血液科,肿瘤科
- 药物治疗
- 3-6月
- 市三甲医院约(10000-50000元)
- 血清乳酸脱氢酶,乳酸脱氢酶,尿溶菌酶
- 常见药品
- 乌苯美司胶囊,注射用甲氨蝶呤,三尖杉酯碱注射液
- 在线购药
疾病症状:
急性髓细胞白血病症状诊断
一、症状
两型急性白血病(ALL和AML)的主要临床表现是大同小异,又各有特点。
1.贫血
如苍白,无力,心悸,气短等,老年病人贫血更为多见。少数病例可在确诊前数月至数年先出现难治性贫血(refractory anemia,RA),以后再逐渐发展成AML(但绝少发展为ALL)。发生贫血的原因有:由于正常造血干细胞因白血病克隆增殖而受抑,红系祖细胞对红细胞生成素(erythropoietin,EPO)的反应性降低,骨髓微环境破坏,使红细胞生成减少;出现无效红细胞生成;合并明显(少见)或隐性溶血,红细胞寿命缩短;合并急、慢性失血,或脾功能亢进等。
2.发热和感染
发热是初诊尤其是化疗骨髓抑制期患者的常见症状,其原因主要是感染,感染可发生在体表、体内任何部位。中性粒细胞减少(当<1.0×109/L时感染机会明显增多)伴功能缺陷,化疗和皮质激素的应用使机体免疫功能下降,皮肤、黏膜(口腔、胃肠道等)出血、溃疡导致屏障破坏是引起感染的主要因素。
3.出血
约60%的初诊AML有不同程度出血,皮肤黏膜(鼻、口腔及牙龈)出血最常见,眼底、球结膜出血较易见,女性可有月经增多,血尿较少见,但镜下血尿不易被发现,严重的胃肠、呼吸道和颅内出血虽不多见却常是致死的原因。急性白血病出血的机制较复杂:骨髓衰竭导致血小板减少是最重要的原因。通常血小板<20×109/L时多伴高危出血倾向,若合并全身感染或严重贫血时更可加重出血;化疗、细菌内毒素和白血病细胞浸润损伤血管内皮以及凝血障碍都是引起出血的因素。
AML-M3亚型(急性早幼粒细胞白血病)的出血比ALL和AML其他亚型更严重而多见,其明显出血往往与血小板减少的程度不相适应,这是因为白血病细胞破坏(尤在化疗开始后),大量促凝物质和组织因子释放,可使50%~75%的M3病例发生弥漫性血管内凝血(disseminated intravascular coagulation,DIC)伴原发纤维蛋白溶解(fibrinolysis),偶尔DIC也出现于AML其他亚型如M5(急性单核细胞白血病)。
4.白血病浸润表现
AML髓外浸润可发生在本病各亚型,但以M5和M4(急性粒单核细胞白血病)为较频见。
(1)皮肤浸润:以M5和M4型多见。外观呈斑丘疹、结节状或肿块,色泽紫红,可多发而布及全身或少数几个散布于体表,且对放疗敏感。偶尔也有在血象、骨髓象出现白血病改变前皮肤浸润先被发现。与AML相关的良性皮肤损害还有多形性红斑、Sweet综合征、脓疮病、坏疽病等,藉皮肤活检可资鉴别。
(2)眼部改变:AML视网膜、脉络膜浸润比ALL少见,可合并出血或引致失明,眼底浸润往往提示合并CNS受累。
(3)口腔牙龈改变:25%~50%的M5和M4患者可因白血病浸润出现牙龈增生,严重者牙龈肿胀如海绵状,表面破溃出血,但AML其他亚型牙龈增生少见。口鼻黏膜、扁桃体或舌体浸润则较不多见。
(4)肝、脾、淋巴结肿大见于约40%的病例(M5型较多见):与ALL相比其发生率较低,肿大的程度也较轻(肝脾通常肋下刚触及至肋下<4cm),明显的肝、脾、淋巴结肿大发生率一般≤10%。对有显著肝脾肿大的患者应注意与慢性粒细胞白血病(chronic granulocytic leukemia,CGL)急性变相鉴别。
(5)骨关节痛:发生率约20%,比ALL少见。骨关节痛易发生在肋骨、脊椎骨,或肢体长骨及肘、踝等大关节,偶尔可出现骨坏死,但关节渗液稀见。胸骨压痛是常见体征,有助于白血病诊断。
(6)中枢神经系统受累(CNSL):初诊AML的发生率不详,但包括复发时的全病程CNSL总发生率儿童为5%~20%,成人约15%,明显低于ALL。年轻(尤其<2岁),周血白细胞和原始细胞数增高,显著肝脾肿大,M4或M5亚型,以及伴染色体单体7或inv (16)(p13;q22)是发生CNSL的高危因素。生存时间愈长的患者CNS受累的发生率也较高。患者可无症状,也可表现头痛等颅内压增高或脑神经麻痹(V,Ⅶ对脑神经为主)等症状。AML的CNS预防性治疗一般不作为常规,但有主张对儿童、M5型或白细胞>100×109/L的患者应给予预防治疗。
(7)粒细胞肉瘤:是由原粒或原单核细胞组成的一种髓外肿瘤,因瘤细胞内含大量髓过氧化物酶使瘤体切面呈绿色,故又名绿色瘤(chloroma),发生率占AML的2%~14%,且更多见于伴t(8;21)染色体异常的患者。粒细胞肉瘤常累及骨、骨膜、软组织、淋巴结和皮肤,好发在眼眶、鼻旁窦、胸壁、乳房、涎腺、纵隔、神经、胃肠道和泌尿生殖系等处。瘤块可于AML诊断时被发现,亦可在AML诊断确立前即出现,并对放疗显示敏感。
AML还可以发生心脏、心包、肺、胸膜、肾及胃肠等各种器官、组织的浸润,但一般很少导致出现临床症状。可能出现的与浸润器官相应的症状、体征大致有心率不齐,心前区收缩期杂音,心包、胸膜出血和积液,肺X线改变,肾肿大,蛋白尿,尿中出现红、白细胞,食欲不振,恶心呕吐,腹痛,腹泻,胃肠出血或表现为阑尾炎等。睾丸、前列腺、卵巢、子宫浸润较少见。
二、诊断
根据临床表现、外周血象、骨髓形态学检查、急性髓细胞白血病不难诊断。1976年法、英、美三国7位著名血液病专家共同观察大量急性白血病患者的血片及骨髓片后制订了FAB分型诊断标准。1985年又进行了修改和补充,以后又有小的修正,目前此标准已为世界各国所接受。我国在1986年也按FAB分型诊断标准修订了国内标准,基本上和国际标准一致。下面介绍AML的FAB分型诊断标准要点,及各型其他特点。
1.急性粒细胞白血病未分化型(M1)
骨髓中原始细胞Ⅰ型(典型原粒细胞、胞质中无颗粒) Ⅱ型(有原粒细胞特征,胞质量少,有少量细小颗粒)>90%,早幼粒细胞少,中性中幼粒细胞及以下阶段粒细胞不见或罕见,至少3%的原始细胞过氧化物酶或苏丹黑染色阳性。M1型占AML的10%~20%,年龄中位数40~50岁,仅1/3有肝、脾或淋结肿大。血象大多呈红细胞及血小板减少,半数白细胞增多,1/4白细胞减少。无特殊的细胞遗传学异常,通常对化疗敏感,预后较好。
2.急性粒细胞白血病分化型(M2)
骨髓原始细胞I Ⅱ型占30%~89%,早幼粒细胞及以下阶段粒细胞>10%。M2型占AML的30%~45%,平均年龄为30岁。常见细胞遗传学异常,其中29%~40%为t(8;21),且Auer小体常阳性。免疫表型除具髓系特点外,可伴CD56及CD19阳性。
t(8;21)累及二个基因,即AML1(21q22)及ETO(8q22),二者形成融合基因AMLl/ETO,在长期CR者仍可检出,故不宜作为复发的指标。t(8;21)主要发生于无MDS病史的M2型,治疗反应好,CR率高,长生存期者多,但儿童患者、伴髓外病变者仍有较高的复发率,寿命较短。男性M2患者常伴Y染色体丢失,女性常伴X染色体丢失。
3.颗粒增多的早幼粒细胞白血病(M3)
又称急性早幼粒细胞白血病(APL)。骨髓早幼粒细胞>30%。如胞质颗粒粗大、密集或融合,称粗颗粒型(M3a);如颗粒细小而密集,称细颗粒型(M3b);如周围血早幼粒细胞颗粒甚少或缺如,而骨髓中仍为典型的早幼粒细胞,称变异型(M3v)。各型Auer小体均多见。
APL占AML的5%~10%,病人常较年轻,年龄中位数30~38岁,10岁以下者罕见,欧洲、中南美洲的拉丁裔民族发病较高。90%的病人表现有继发DIC的出血,系白血病细胞颗粒释放促凝物引起。部分病人释放促纤溶物质,致纤溶亢进而出血。但自从应用全反式维A酸(ATRA)后,出血、特别是严重出血者已少见。外周血白细胞常常减少,且大多为M3a,而白细胞升高者多见于M3b及M3v。早幼粒细胞由于有大量颗粒,有时还伴大量柴束样的Auer小体,使细胞核观察不清,故又称为“雾细胞”。
染色体17q21含有维A酸受体(RAR)α基因,而15q24是早幼粒细胞白血病基因(PML)所在的位置,95%以上的早幼粒细胞白血病发生t(15;17),所形成的融合基因有两种形式:
①PML/RARa,位于15P 及它的互补位置。
②RARα/PML,位于17P-。前者见于所有的M3型患者,后者则见于2/3的M3型患者。PML 在 15号染色体基因断裂点有3种,分别为长型、短型及变异型。长、短型皆对ATRA治疗反应好,但短型的预后仍差于长型,而变异型对ATRA敏感性差,且常伴其他的细胞遗传学异常,预后最差。APL还有非t(1 5;17)的其他细胞遗传学异常,如t(5;17)(NPM/RARα、t(11;17)(PLZF/RARa)。此两种类型的APL对ATRA耐药,预后差。
4.急性粒-单核细胞白血病(AMMOL,M4) 粒-单系二种细胞以不同比例同时存在于骨髓和周围血中,包括:
①M4a:原始和早幼粒细胞增生为主,原、幼单核和单核细胞>20%;
②M4b:原、幼单核细胞增生为主,原始和早幼粒细胞>20%;
③M4c:原始细胞既呈粒细胞系、又呈单核细胞系形态特征者>30%;
④M4E:除上述任一项条件者,同时存在5%~30%的细胞伴粗大而圆的嗜酸颗粒及着色较深的嗜碱颗粒,前者电镜下无中心晶体样结构。
AMMOL占AML的5%~10%,年龄中位数40~45岁,肝脾及淋巴结肿大多见。血白细胞大多升高。其中20%~25%>100×109/L。CNS-L、齿龈及皮肤浸润多见。
M4E几乎均有inv(16)(p13;q22),导致编码平滑肌肌球蛋白链基因(MYH11)和编码核结合因子β单位基因(CBFβ)发生融合,即MYH11/CBFβ10%的无嗜酸细胞增多的M4也可检出MYH11/CBFβ长期临床CR的M4E患者,其MYH11/CBFβ仍可存在。
M4E易累及CNS,故必须采取预防措施,全身用大剂量阿糖胞苷可降低CNS-L的发生率。M4ECR率高,预后相对较好。
少数M4型合并血嗜碱粒细胞增多,骨髓常有三系病态造血及环状铁幼粒细胞,伴t(6;9),预后差。
5.急性单核细胞白血病(AMOL,M5)
骨髓原始单核细胞≥80%,称未分化型,即M5a。原始单核细胞<30%,称分化型,即 M5b。
AMOL占AML的2%~10%,M5a患者年龄偏小,75%<25岁。M5无特异性的染色体异常,但常累及第11号染色体,如t(11;9)、t(11;17)、t(11;19)、11q23平衡易位,与混合白血病(MLL)基因有关,MLL基因的氨基端分别和9号染色体的AF9基因及19号染色体的DNL基因融合。
50%的AMOL有髓外病变,包括CNS、皮肤及齿龈等,肝脾肿大多见。CNS-L发生率为3%~22%。血白细胞常明显升高,10%~30%伴白细胞血症。DIC的发生率也较高,以往仅次于APL,ATRA应用后DIC的发生率可能已跃居AML的首位。部分AMOL患者可伴蛋白尿,甚至肾功能不全,可能与血清溶菌酶水平升高而损伤肾有关。AMOL的CR期较短,预后差。
6.红白血病(M6)
当骨髓中红系细胞>50%,或红系细胞>30%,但其中15%以上为形态异常的幼红细胞,上述两种情况之一伴原粒细胞或原始单核细胞≥30%(非红系细胞计数即可),即为红白血病。幼红细胞常伴胞质空泡、核异常及类巨幼变。
M6占AML的5%以下,年龄多>50岁,男性多于女性,几乎均有明显的贫血及血小板减少。不少病例属继发性白血病,包括从MDS转化而来,故预后差。有报告1/3病例有骨痛,部分骨痛病例抗核抗体、类风湿因子及抗人球蛋白试验阳性,可伴高丙种球蛋白血症。
7.急性巨核细胞白血病(AMKL,M7)
骨髓原始巨核细胞≥30%时,并经免疫分型或电镜血小板过氧化物酶染色阳性证实。若骨髓“干抽”,有骨髓纤维化,则需行骨髓活检,经免疫组化证实有原始巨核细胞增多。
M7占AML的5%以下,是AML中最少见的类型,临床表现和其他AML相似。肝脾及淋巴结肿大少见。周围血细胞常减少,但30%患者的血小板>100×109/L,血小板聚集功能降低。血清乳酸脱氢酶(LDH)常明显升高。部分病例放射学显示骨硬化及骨溶解,此在急性白病中罕见。
此外,尚有一M0亚型,血及骨髓中出现原始细胞,无Auer小体,过氧化物酶染色阴性,难以诊断为AML,但免疫表型检查有髓系表型,CD13、CD33阳性,髓过氧化物酶阳性,CD34也阳性,表明白血病细胞来自髓系。细胞遗传学检查常伴5q-、或7q-。患者白血病细胞常有多药耐药基因表达,化疗反应较差。
疾病病因:
急性髓细胞白血病疾病病因
一、发病原因
1.化学物质
长期密切接触有机溶剂者,发生AML的危险升高,中国一组流行病学调查显示,生产苯工厂的职工发生白血病的危险是普通人群的5~6倍,自接触至发病,即潜伏期,平均为11.4年。连续吸入高浓度苯的实验小鼠,80天后11%的雌鼠及19%的雄鼠发生AML。
吸烟者患白血病的危险是普通人群的2~3倍。烟草中含苯、乌拉坦、亚硝胺,还有放射性物质。吸烟每天超过40支者发生AML后发现有5号或7号染色体异常。
较长期应用烷化剂或鬼臼毒素类的肿瘤和非肿瘤病人发生白血病的危险较正常人群高出250倍以上。国内银屑病患者应用乙双吗啉、乙亚胺等细胞毒药物1~7年(平均30个月)后,发生白血病的病例已超过200例,且大多为AML。
2.电离辐射
电离辐射诱发白血病已获证实。1984年全国26个省、市、自治区调查30年内从事临床X线工作者2万余人,白血病的标化发生率是对照组的3.5倍,AML占34.4%。接受X线治疗的强直性脊柱炎患者,其白血病发生率为同年龄组的9.5倍。日本遭原子弹爆炸辐射影响的人群,白血病发生率为正常人群的4~40倍,且和受辐射的剂量成线性关系。上述受辐射人群发生白血病共766例,其中48%为AML。多种实体瘤放疗后发生白血病的危险增加2倍。
3.遗传
遗传已被证明是白血病发病的重要危险因素之一,单卵双胎之一发生白血病后,其同胞在一年内发生白血病的机会是正常人群的5倍。白血病高危家族中有较高的白血病发生率,是正常家族的16倍。伴特殊染色体异常的遗传病,如Down综合征、Fanconi贫血、Bloom综合征、神经纤维瘤病等的白血病发生率远高于正常人群。
某些获得性疾病可转化为AML,最常见的是骨髓异常增生综合征(MDS)转化为AML,以往曾将转化前的MDS称之白血病前期。由MDS转化的白血病绝大多数为AML。其他如真性红细胞增多症、原发性骨髓纤维化等骨髓增生性疾病在病程后期均有转化为AML的可能,少数不典型的再生障碍性贫血、阵发性睡眠性血红蛋白尿症也可转化为AML。
二、发病机制
上述各种可能病因究竟如何促发或转化为AML,此机制尚不清楚。
从染色体及基因水平予以讨论。
1.染色体异常
AML的染色体异常,像急性淋巴细胞白血病一样,可分为2大类:
①染色体结构异常,如染色体结构中某一部分缺失(del)、重复(dup)、倒位(inv),或两个染色体中的某一结构(基因)断裂,相互易位(t),形成融合基因;
②染色体数量的改变,如某一染色体的长臂或短臂缺失(-p,-q),或增加( p, q)。
2.染色体及基因异常与AML分子发病机制的联系
大多数AML是由于获得性造血干细胞或祖细胞的基因突变所致,只有极少数是遗传或家族性的。造血干、祖细胞基因突变,多数原因不明。已知的原因有放射线接触,某些化学物质的作用,尤其是化疗药物如烷化剂,拓扑异构酶Ⅱ抑制剂(如足叶乙甙)等。由于治疗所引起的AML称为t-AML,近年来报道增多。少数AML的发病机制是由于基因突变加快、DNA修复缺陷、DNA复制错误所致。
基因的突变可表现为染色体的异常,本质是基因组的某一核苷酸序列发生断裂或突变。
(1)融合基因:
在表1中所列举的染色体异常及其累及的基因中,与AML发病机制研究得较多和了解得比较清楚的基因及其融合基因有以下3种。
①第11号染色体的q23:累及的基因名为MLL(髓-淋白血病基因)。MLL正常表达于脾、肝、肺、心、脑、T及B淋巴细胞。由于它与果蝇的trithorax蛋白有同源性,故又称为HTRX或HRX基因。通过基因相互易位而与MLL融合的基因不下30个。正常时MLL是一种转录因子。在AML中,MLL与其配对的基因融合,有的已经克隆。融合基因使MLL的正常基因转录调节发生障碍,可能是引起AML及其表型(常见M4、M5型)特点的机制。
②第21号染色体q22:涉及的基因名为AML1。AML1正常表达在造血细胞。它是核心结合蛋白(CBL)的亚单位,通过一个名为rhd(runt同源区域)与CBFα形成一种复合物,后者有利于CBF结合在DNA上。AMLl-CBF复合物是一种转录因子,与共激活因子ATEF/CREB及P300/CBP以及DNA结合蛋白LEF-1及其接头的蛋白ALY一起,形成复合转录因子,调节IL-3、髓过氧化物酶、T细胞受体、GM-CSF受体(CSF-1R)。这些受体通过AML1结合在DNA上,正常时起转录激活作用。若与Groucho或Ear-2蛋白结合,则起转录抑制作用。在正常情况下,ETO表达于大脑中的某些细胞、CD34 造血祖细胞。在t(8;21)(q22;q22)中,AML1与ETO结合形成融合基因。ETO募集核的共抑制物Sin3A、N-CoR以及与它们结合的组蛋白去乙酰化酶(HDAC),抑制AML1的转录激活作用。这一AML1-ETO与核抑制物的复合物,不仅能抑制AML-l的正常功能,而且也抑制ETO的功能,因而扰乱AML-1的转录调节作用,这可能是M2b型AML的发病机制。
③维A酸受体α(RARα)及早幼粒细胞白血病(PML)基因。
(2)非融合基因:
①p53基因:p53基因定位于人染色体17p13.1,编码53kD的蛋白。人p53蛋白由393个氨基酸组成,含有4个功能区。野生型P53蛋白是核内的一种磷酸化蛋白,作为转录因子可与特异的DNA序列相结合,一定的外界刺激如DNA损伤、应激等可引起胞内p53蛋白水平升高,激活一系列下游靶基因的转录,抑制细胞周期的进行或诱导凋亡。目前已知的靶基因至少有7个。p53基因抑癌功能丧失是恶性肿瘤最常见的现象之一。在血液恶性肿瘤中,p53基因失活与CML急变的关系受到重视。最近有研究者发现CML中p53基因的结构和表达异常,等位基因缺失重组,或点突变,约见于25%的CML急变患者。
②nm23基因:nm23基因存在nm23-H1和nm23-H2两种亚型,位于人类染色体17q21.3相距4kb。均含有5个外显子。两种亚型位于外显子-内含子连接区的大部分切割位点是一致的。nm23基因编码一个17kD蛋白。两种基因亚型编码的蛋白质分别与核苷二磷酸激酶(nucleosi dediphos phate kinase,NDPK)的A、B亚单位相对应,NDPK影响细胞的发育、增殖、分化及运行调节。而nm23-H1和nm23-H2的一个等位基因失活可能导致NDPK A、B亚单位比例的失衡,引起细胞活动的改变,促进肿瘤的浸润及转移过程。nm23基因在一些肿瘤中表达下降与高转移潜力有关,在血液病中则作为一种分化抑制因子基因参与疾病的发生、发展过程。但人们尚未确切阐明nm23基因如何参与白血病的发生。促进白血病细胞的增殖和对细胞分化的调控作用。
③BCL-2:BCL-2是控制细胞凋亡基因家族中的一员。定位于人类染色体18q21.3,由3个外显子组成,编码229个氨基酸组成的膜蛋白,具有抗凋亡作用, BCL-2可与BAX形成异二聚体,BCL-2/BAX比率是影响细胞凋亡的关键,若BCL-2表达高,则抑制细胞凋亡,反之,若BAX表达高,则促进细胞凋亡。体外实验显示,BCL-2表达增高能使白血病细胞抵抗糖皮质激素、VP-16、柔红霉素、米托蒽醌等药物所诱导的凋亡。同时研究者发现,BCL-2高表达明显延长白血病细胞生存时间,抑制或阻断多种因素包括p53、c-myc、化疗药物、撤除生长因子等所触发的细胞凋亡。另外,BCL-2家族与白血病耐药有关,高表达BCL-2的白血病细胞对化疗药物不敏感、预后差。
④p16:p16基因是重要的抑癌基因,位于染色体7p21,编码16kD蛋白,又名多肿瘤抑制基因。p16蛋白抑制细胞周期蛋白依赖性激酶(CDK)4和6,是细胞G1/S期转换的关键调控基因。Hebert等报道p16基因缺失、突变在急性T淋巴细胞白血病(T-ALL)检出率最高,达22/24,而在前B细胞白血病p16基因缺失检出率为11/53。但在AML中批p16基因缺失、结构改变等异常少见,提示在造血系统恶性肿瘤的发生和演变中。p16具有不同的作用。
⑤WT-1:WT-l基因与肾母细胞瘤(Wilm’s tumor,WT)相关。有实验证实,WT-l是人早期生长反应基因(EGRl)的功能拮抗蛋白,WT-l表达限于肾脏和泌尿生殖系统前体细胞,可能通过阻滞ERGl的促增殖作用,间接促进细胞分化而起抑癌作用。WT-l基因与血液系统恶性肿瘤的关系不甚清楚,但发现白血病细胞常表达WT-l。
⑥其他基因:FMS编码CSFI受体,其突变及等位基因缺失,可能在某些白血病的发病中具有重要作用,如FMS突变在M5型AML中发生率高。ras基因突变在AML中的发生率可达30%。抑癌基因Rb基因失活在各型白血病的发生率为10%~30%左右。但上述各种单基因异常与AML的发病分子机制之间的关系尚待进一步阐明。
疾病预防:
急性髓细胞白血病预防
减少或避免有害物质 如电离辐射,化学物质、化学药物的接触。
2.对于某些获得性疾病可能转化为AML的应早期给予积极治疗。
疾病鉴别:
急性髓细胞白血病鉴别诊断
需和AML鉴别的有下列疾病:
1.急性淋巴细胞白血病(ALL) 临床上二者相似,仅症状和体征的频度和程度上有所差异,如浸润表现ALL更为常见及显著。形态学检查可区分大部分AML和ALL,困难者加做细胞化学检测,绝大多数病例可确诊。少数病例需行免疫表型检测鉴别,仅极少数病例还需进一步经细胞遗传学(或)和分子生物学检测。
2.类白血病反应 常见的类白血病反应表现为血白细胞升高,伴少数中、晚幼粒细胞,骨髓显示粒系左移,因此类似慢性粒细胞白血病。少数类白血病反应,血液学特点为全血细胞减少,血片中出现原始细胞,骨髓原始细胞也明显增多,甚至>30%,称之类急性白血病反应,鉴别点为有原发病(各种严重感染,粒细胞缺乏症恢复期等)、血中性粒细胞碱性磷酸酶染色积分明显升高、原始细胞短期内数量有明显波动,且无Auer小体、血液学改变随原发病好转、控制而逐渐恢复正常。
3.再生障碍性贫血(AA) 主要和非白血病性白血病及低增生性AML鉴别。根据AML浸润的临床表现及骨髓检查(包括活检)不难区分。
4.传染性单核细胞增多症(IM) IM有和急性白血病类似的临床表现,如发热、肝脾及淋巴结肿大,血片中如有较多的异常淋巴细胞,有时和ALL或AML可混淆。通常经检查血清EB病毒标志物、嗜异性凝集试验及骨髓象可鉴别。此外,IM病程有自限性,4周左右即恢复正常。
5.恶性组织细胞病(MH) 此外,AML有时尚需和全血细胞减少的巨幼细胞贫血鉴别,尤其是M6型,因为二者骨髓中红细胞系均有巨型变。根据AML骨髓中>30%的原始细胞存在,及叶酸、VitBl2治疗3~4周无效,可明确区分。
疾病检查:
急性髓细胞白血病检查
1.外周血
外周血白细胞可以正常、升高或减少,各占1/3的比例。但不论白细胞总数是多少,其中白血病胞占了85%。有10%~15%的AML病例患病时的外周血白细胞数超过100*109/L,即高白细胞症,多见于M4或M5型的患者,常伴肺部、中枢神经系统浸润、肿瘤溶解综合征和白细胞黏滞症,属高危型,预后差。极少数患者外周血白血病细胞大于30%,而骨髓中少于30%,未达到急性白血病诊断标准,称之为外周血型急性白血病,其中部分病例的骨髓白血病细胞数可能在随后的几个月内高,对这些患者尤其老年AML患者,在外周血血小板和粒细胞减少并具有明显危险性时(血小板<20*109/L,粒细胞<1*109/L),可以暂缓化疗。
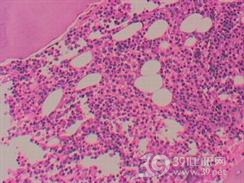
2.骨髓象
多数患者极度增生,正常造血细胞被白血病细胞取代;少数患者骨髓增生低下,但原始细胞仍在30%以上。白血病细胞常有形态异常和核、浆发育不平衡。如胞质内发现Auer小体,更有助于排除ALL而确诊为AML。有时可遇骨髓干抽现象,原因是白血病细胞极度积聚,致骨髓过分黏稠,或合并骨髓纤维化所致,此时须做骨髓活检确诊。
根据形态学和细胞化学特点,1976年FAB协作组指定了急性白血病分型诊断标准,并于1985年进行了修订和扩充。
3.细胞化学染色
细胞化学染色可补充形态学的不足,在急性白血病的类型鉴别上起着重要作用。常用的细胞化学染色方法包括髓过氧化物酶染色(MPO)、苏丹黑B染色(SBB)、氯醋酸AS-D萘酚酯酶染色(NAS-DCE)、α-丁酸萘酚酯酶染色(α-NBE)、α-醋酸萘酚酯酶染色(α-NAE)、过碘酸-雪夫染色(糖原染色、PAS)、酸陛磷酸酶染色(ACP)、碱性磷酸酶染色(NAP)、溶菌酶等方法。必要时可做酯酶双染色和Phl(φ)小体等。根据上述方法,将FAB各型初步分类。
4.电镜检查
电镜检查通过观察细胞的超微结构,提高急性白血病形态学分类的正确性。急性粒细胞白血病、急性单核细胞白血病、急性淋巴细胞白血病和巨核细胞白血病的白细胞相互之间的鉴别,可借助电镜细胞化学染色来明确诊断。目前电镜细胞化学染色有MPO染色和血小板过氧化物酶(PPO)等。其优点是灵敏度高,特异性高,能揭示白血病细胞部分早期分化特征。例如MPO反应对非常幼稚的原粒细胞白血病最具诊断价值,AML的原粒细胞对MPO反应强阳性( ),原粒细胞对MPO的反应不仅限于颗粒,亦见于内质网、核膜和高尔基体;急性单核细胞白血病原始细胞反应弱阳性( ),部分细胞阴性;而急性淋巴细胞白血病和巨核系的原始细胞均无反应。PPO阳性反应是巨核细胞和血小板的特有标志,巨核细胞对PPO反应为阳性( ),而急性粒细胞白血病、急性单核细胞白血病和急性淋巴细胞白血病的原始细胞均阴性。
5.细胞免疫表型
常用的髓细胞系抗体为MPO、CD33、CD13、CDllb、CDl5、CD14,其他与髓系相关的抗体是CD34、HLA-DR等,抗血型糖蛋白单抗以及抗血小板糖蛋白Ⅱb/Ⅲa、Ⅰb(CD41a、CD41b、CD61、CD42a、CD42b)分别被认为是鉴别M6和M7型ANLL敏感而特异的单抗,90%以上M3型ANLL以CD33 、HLA-DR为特点,CDl4是单核细胞特异性抗体,然而敏感性不够高,在M4和M5型ANLL中,阳性率约占70%。以上髓细胞免疫分型同样有助于慢性粒细胞白血病急变类型的鉴别。
6.细胞遗传学检查
通过传统方法检测,有50%±10%的AML病例有异常的染色体核型,而染色体显带分析,荧光原位杂交(FISH)等细胞遗传学技术及聚合酶链反应(PCR)、Northern、Southern及Western印迹等分子生物学技术的发展和应用,使人们对急性白血病细胞遗传学和分子生物学有了更深入的认识。染色体改变包括结构和数量的异常(表1,2,6)。
(1)染色体结构异常:
①t(8;21)(q22;q22)和inv(16)(p13;q22):是初治AML患者中的最常见的细胞遗传学异常。t(8;21)占青年和儿童AML患者发病率的5%~10%,主要与M2型密切相关,同时也可见于M1和M4的病例中。在成人白血病,t(8;21)的存在表明该患者对化疗反应良好,缓解率高,中位生存时间长,但在儿童白血病,t(8;21)的存在表明患者对治疗反应差。伴随inv(16)和t(16;16)的AML病例有其独特的形态学表现:即急性粒单细胞白血病和M4E0,占成人和青年AML的10%~12%,嗜酸细胞>5%。多数伴inv(16)的AML病例,特别在有AML-M4-E0型样的形态学改变的预示着有较好的预后,这一异常的染色体表达还可存在于其他的如M2,M4,M5分型的AML病例中。
②t(9;22)(q34;q11):在初治AML的发生率占1%,t(9;22)通常单独出现而不伴有复合染色体的改变,但有时伴t(9;22)易位的AML可出现-7及不同的三倍体。
③t(15;17)(q22;q21):是M3(APL)的特异性染色体改变,见于90%以上的M3病例。1%~2%APL患者有t(11;17)易位,个别患者存在t(5;17)易位。具有典型t(15;17)的患者对全反式维A酸(ATRA)有良好的治疗反应,而其他二型对ATRA无反应。
④11q23重排:累及11q23条带重排形式的多见于AML(M4)、ALL、MDS和继发于曾经接受拓扑异构酶Ⅱ抑制剂而引起的AML。目前发现有大约30种的不同的染色体区带可与11q23发生易位。例如t(11;19)常见于婴儿白血病,经诱导分化治疗后具有髓系和淋巴系双表型特征,说明染色体易位可能发生在多能造血干细胞阶段;在90%以上伴有11q23异常的白血病患者,可以累及不同的基因,一般认为,累及11q23上的MLL(ALL-1,HRX,Ht-2X)基因通常预后较差。
⑤inv(3)(q2l;q26):伴inv(3)(q2l;q26)的AML是一个独特亚群,常伴微小巨核细胞增多和异常血小板增生,这些血液学异常也可见于t(3;3)(q2l;q26)的病例。累及3q异常的血液病患者预后通常较差。
(2)染色体数量异常:
① 8:是AML最常见的核型改变,约占AML患者核型异常的20%。 8作为原发改变多见于M1、M4和M5,在M3型中较少见,而作为继发改变,多见于M3型,也偶见于M2型。
② 21:有1%的发生率,而且多发生于同时有del(5q),-7染色体改变的AML病患。
③-7:在AML患者中有1%~3%的发生率,其出现可能与接触某些化学物质有关,伴有-7的AML患者对治疗不敏感,并代表该疾病的不良预后。
④-5:与毒物接触有关,常见于治疗相关的AML(t-AML)。
⑤性染色体减少:常见于M2型,伴随t(8;21)。作为单一核型异常,-X明显比-Y少。在临床上,骨髓细胞-Y往往代表正常男性老年化现象,但有时是肿瘤细胞惟一的核型改变。
7.分子生物学检测
有的融合基因如PML-RARα、AMLl-ETO需要用分子生物学技术才会予以确诊(即所谓MCIM分型),或观察残余白血病。而有的如前文所述,单基因如N-RAS、K-RAs和BCL-2等癌基因和肿瘤抑制基因RB1和p 53等质或量的表达异常可能与某些AML的发生有关。这些基因检测对预测AML的预后有一定价值。
(1)p53:p53在AML中的表达低,往往预示预后差。
(2)nm-23 :nm-23-H1、nm-23-H2mRNA在AML、CML-BC中,水平增高,在CML-CP则正常,nm-23-H1和nm-23-H2在有染色体异常AML-M2和AML-M3中的表达比无染色体畸变的其他类型的AML亚型低;而在AML-M6病例中nm-23表达水平极高。
(3)BCL-2:在AML中,M1、M2亚型的BCL-2表达高于M3、M4、M5,并且高表达者生存时间短,化疗效果差。
(4)p16:AML中p16的同源基因p15功能灭活率高达86%,另外,初治和复发AML其骨髓细胞p16表达活性明显低于正常对照和处于长期缓解AML的骨髓细胞。
(5)WT-1:白血病患者诊断初期的骨髓中的WT-1基因呈高度表达,而当该患者经过治疗临床达到缓解后,WT-1基因消失,有研究者动态观察了33例白血病患者(26例AML患者,7例ALL患者)和6例正常人的外周血中的WT-I基因表达,发现6例正常人均未检测出WT-1转录的最低水平(<10-4),而3l例(93.9%)白血病患者的WT-l在疾病初期呈不同水平的表达(10-4~101),而且WT-l基因的表达在AML和ALL无差异,研究者又随访检测了31例获得CR后的白血病患者的外周血的。WT-1水平表达,共有5例病例复发,(其中2/18例患者并不能检测出WT-1表达,而3/13患者检测出低水平的WT-1表达),该5例患者中的3例在复发时WT-1表达再次升高,提示T-1是一敏感的肿瘤标记,能用于监测白血病患者经化疗或CR后的微小残留病灶。
8.一些AML患者的血清和尿液中的乳酸脱氢酶(LDH)和溶菌酶升高,
而这些指标的升高表示着肿瘤相应的负荷量,多见于M5和M4型患者。钙代谢混乱相对少见,表现为高钙血症或低钙血症。可能与白血病细胞产生并释放一些甲状旁腺素样物质有关。
9.骨髓病理
白血病患者全身骨髓均有白血病细胞增生浸润,肉眼可见骨髓呈棕色,或灰白略带绿色脓样色泽,如有出血则呈暗红色或红褐色,白血病细胞增生严重时长骨中的黄髓也可被红髓所代替(即由白血病细胞增生所占据)。白血病常伴有骨小梁减少变细或虫蚀样缺损,这与骨髓内压力增高以及骨小梁供血不足有关。网状纤维增多或胶原纤维增生。
10.凝血异常
出现DIC时可出现血小板减少,凝血酶原和部分凝血活酶时间延长,血浆纤维蛋白原减少,纤维蛋白降解产物增加和凝血因子Ⅴ、Ⅶ、Ⅷ、Ⅹ等的缺乏。
11.代谢异常
高尿酸血症常见于白细胞数增高和诱导化疗期患者,且与肿瘤溶解有关,但AML的高尿酸血症发生率比ALL低;血清乳酸脱氢酶(LDH)可升高,尤其是M4、M5亚型,其增高程度一般也轻于ALL;血清溶菌酶(1ysozyme)增高亦以M4、M5型多见;过量溶菌酶可损伤肾近曲小管,加上白血病本身的代谢异常,抗生素、利尿剂等治疗的影响可导致低钾血症;高钾血症的出现与肿瘤溶解及高尿酸血症有关;有时还可发生低钙或高钙血症。
疾病就诊:
疾病治疗:
急性髓细胞白血病一般治疗
急性髓细胞白血病西医治疗
一、治疗
AML各亚型中,除APL之外,治疗基本相同。
1.诱导缓解化疗
AML的经典诱导化疗是DA方案:柔红霉素(DNR )45~60mg/(m2·d)
(第1~3天) 阿糖胞苷(Ara-C) 100mg/(m2· d) (第1~5天或第1~7天),第一疗程完全缓解率(CR)为40%~50%;第二疗程达60%~75%。
其他诱导化疗方案如下:
①AID 方案:阿糖胞苷(Ara-C) 伊达比星(去甲氧柔红霉素)或阿糖胞苷(Ara-C) 伊达比星(IDA) 依托泊苷(VP-16)(ICE);
②阿糖胞苷(Ara-C) 柔红霉素(DNR) 硫鸟嘌呤(6-TG);
③米托蒽醌(NVT) 依托泊苷(VP-16)(ME)等。临床研究表明,在DA方案基础上加用依托泊苷(VP-16)并不进一步提高完全缓解率,但可以提高总生存率。而加用硫鸟嘌呤(6-TG)对完全缓解率和总生存率无显著意义。伊达比星(IDA)在诱导化疗中的作用逐渐得到认可,其优势在于恶性肿瘤细胞毒性强,尤其对伴多药耐药表型白血病细胞作用强于柔红霉素(DNR),心脏毒性低。单疗程缓解率高,并且适用于老年患者。标准用法如下:12mg/m2,第1~3天。近来ACG组(AML collaborative Group)总结了5项大规模的临床随机对照研究,共1052例AML。结果伊达比星(IDA)与柔红霉素(DNR)组比较早期治疗失败/死亡率接近,而晚期治疗失败/死亡率则明显减低(P<0.0001);总体缓解率伊达比星(IDA)组高于柔红霉素(DNR)组(P=0.002)。伊达比星(IDA)组无病生存(DFS)和总生存率均略高于柔红霉素(DNR)组(P=0.07和P=0.03)。因此,伊达比星(IDA)已经逐步成为临床研究中标准的诱导化疗方案之一。
阿糖胞苷(Ara-C)是诱导化疗方案中重要的组成部分,其常规剂量为100mg/m2第l~7天,临床研究表明,7天疗程效果优于5天疗程,而与10天疗程相近;持续静脉点滴优于单次、分次注射;200mg/m2并不提高疗效。近年来,由于中-大剂量阿糖胞苷(Ara-C)在AML缓解后治疗取得明显效果,因此部分学者尝试应用大剂量(HiDAC)进行诱导缓解治疗。部分研究提示在年龄<50岁的AML病例可取得近90%的CR率,而且与常规剂量比较,能进一步延长患者的DFS。因此目前美国肿瘤协作网(NCCN)推荐HiDAC作为AML诱导缓解的方案之一。
2.缓解后治疗
诱导治疗达到CR后,大剂量巩固和强化治疗在AML的后续治疗中有重要的地位,它在很大程度上将决定AML的持续缓解时间,患者生存率及复发的时间。目前主张缓解后治疗应该是强烈的巩固治疗,这些方案的强度至少与诱导缓解治疗方案相同。应用这样的方法,中位CR期达18~24个月,20%~45%达CR的患者无病生存期达15年,主要方法如下。
(1)定期强化治疗3年方案:阿糖胞苷(Ara-C),100mg/m2十硫鸟嘌呤(6-TG)100mg/m2,12 h重复一次至骨髓抑制,每个月重复。一个治疗疗程约10天,12~18个月后7天。适用于各年龄段患者,长期DFS预期>10%~20%。
(2)短程大剂量巩固化疗方案:阿糖胞苷(Ara-C),2~3g/m2静脉注射3h;12h重复一次;第1、3、5天;每28~35天重复或根据外周血计数恢复程度调整。5年DFS预期44%;治疗相关死亡5%;适用<45岁AML;45~60岁神经毒性大(12%);>60岁疗效差且副作用大。目前以大剂量阿糖胞苷(Ara-C)为基础,加或不加用其他药物(常规剂量),如柔红霉素(DNR)、伊达比星(去甲氧柔红霉素)、依托泊苷(VP-16)、米托恩醌等。
3.造血干细胞移植
(1)异体骨髓和造血干细胞移植(Allo-BMT或Allo-HSCT):Allo-BMT或Allo-HSCT是目前惟一能根治白血病的方法。临床实践已经表明,应用Allo-BMT/Allo-HSCT治疗AML可有效控制疾病的复发,长期DFS在40%~55%。与疗效关系密切的因素是病例和供者的选择和骨髓移植的时机。国外多组单中心研究表明,同胞供者HLA相合的移植,第一次完全缓解期进行,长期DFS(以下简称DFS)达45%~70%;复发早期(ER,early relapse)或第二次完全缓解期进行,DFS 20%~35%;难治/复发病例DFS 10%~15%;诱导缓解治疗无效病例行移植,DFS 21%~43%。关于移植治疗和化疗的前瞻性研究提示,Allo-HSCT治疗的优势在于减少复发,提高DFS。
鉴于AML(APL除外)迄今复发率甚高,即使已规划3~5年DFS仍只有20%左右,因此对这些患者,在获得CR1后,只要年龄及其他条件许可,原则上应尽可能争取进行HSCT治疗。
(2)自体骨髓/造血干细胞移植(Auto-BMT/Auto-HSCT):Auto-HSCT适用于多数AML病例(<60岁),且移植相关并发症和死亡率低,长期生存可达到35%~50%。但Auto-HSCT缺乏GVL效应,主要的缺陷是复发率高。Zittourn总结了1986~1993年由欧洲59个研究中心参加的随机对照研究,共941例AML病人。平均随访时间40个月。其中完全缓解623例(CR率66%),576例接受了一疗程的强化治疗。168例接受Allo-BMT治疗,254例患者进行随机分组:128例接受ABMT,126例接受第二疗程强化疗。可评价病例中Allo-BMT l44例,ABMT 95例,化疗104例。结果发现,3组病例生存期无显著差异:Allo-BMT组4年总生存(OS)59%,化疗组46%,ABMT组56%(P=0.43)。复发率比较化疗组(57.1%)高于ABMT组(40.6%)和Allo-BMT组(24.4%),而治疗相关死亡率则Allo-BMT(17.3%)高于ABMT(9.4%)和化疗组(7.1%)。无病生存率化疗组30%,ABMT组48%,Allo-BMT组55%(P=O.04)。自体骨髓移植净化一直是自体骨髓移植治疗的研究重点之一。Linker CA等报告了应用四氢过氧环磷酰胺(4-HC,100mg/ml)处理自体骨髓细胞治疗的长期随访结果。第一次完全缓解期AML共50例,预处理方案为白消安(busulfan)16mg/kg 依托泊苷(足叶乙甙)60mg/kg。随访时间平均6.8年(最少4.5年)。结果治疗相关死亡2例,复发13例,DFS 70%,复发率27%,总生存率为72%。这是目前随访时间最长和疗效最佳的一组报告,而其他的一些研究却未能表明体外净化处理移植的优越性。主要因素在于不同的研究组在病例选择,净化药物等多方面有较大差异,而净化体系效率缺乏标准化的检测手段,因此目前净化效应仍是有待进一步研究的课题。
4.特殊类型的治疗
M2b诱导分化治疗:AML-M2b患者90%伴t(8;21)特异性染色体改变,形成AML-ETO融合基因。近年来,国内外学者进行了大量的实验研究,以探讨M2b的诱导分化和凋亡疗法,研制新的诱导分化剂。苯丁酸钠对许多肿瘤细胞如HL-60(人早幼粒细胞白血病)、MEL(小鼠红白血病)有抑制增殖、促进分化作用。美国国立健康研究院的一组研究者发现维A酸(ATRA)与苯丁酸钠使用有协同作用,故认为苯丁酸钠可能有应用前途。目前M2b的诱导分化疗法尚处于实验阶段,临床疗效尚待肯定。
5.难治及耐药AML的治疗
按目前AML治疗水平,仍有10%~30%的患者对一线标准诱导方案无效,40%~80%已经获得CR的患者最终还要复发。
难治(refractory)和复发(relapsed)AML对再治疗的耐药程度和治疗反应是各不相同的,并取决于疾病本身的异质性、复发的性质、时机和次数,尤其是初次缓解(CR1)期的长短。凡一线方案充分治疗无效,CR后6个月内复发,或复发后经再治疗不能达到二次缓解(CR2)的患者属于高度耐药的AML。文献报道CR1<1年和≥2年的初次复发者,使用原标准方案再诱导的CR2率分别为30%~50%和50%~60%,其中CR1≥2年者,3年DFS可达20%~25%;反之,CR1<1年者的CR2率仅10%~30%,3年DFS为0%。为区分高度耐药的难治病例与一般复发病例,使不同作者报道的治疗结果具有可比性,各国学者讨论了难治性AML的各种判断标准,其中德国AMLEG协作组提出的四项标准最为通用,即:①标准方案诱导化疗2疗程不缓解;
②CR1后6个月内复发;
③CR1 6个月后复发,且原诱导方案再治疗无效;
④二次和多次复发。需要说明,因诱导化疗剂量不足导致治疗无效者,可能对标准剂量方案依然敏感,并能获得缓解,这类病例并不属于难治性AML。
为克服临床耐药,难治和复发AML的治疗选择是:
①使用与一线治疗无交叉耐药的其他药物组成的新方案;
②使用HD、ID阿糖胞苷(AraC);
③应用耐药逆转剂;
④采取造血干细胞移植。
HD、ID阿糖胞苷(Ara-C)为主的各种联合方案是难治和复发AML最常用的挽救治疗方案。通常与HD、ID阿糖胞苷(Ara-C)联合使用的药物有米托蒽醌(MTZ)、伊达比星(ida)、依托泊苷(VP-l6)、安吖啶(m-AMSA)和门冬酰胺酶等,报道CR率30%~70%,但中位DFS一般≤6个月,3年生存率仅7%。米托蒽醌(MTZ) HD、ID阿糖胞苷(Ara-C) 依托泊苷(VP16)是近年探索较多疗效相对较好的难治、复发AML治疗方案,报道CR率大都在50%以上,对CR1<6个月的早期复发者也有较高疗效。Amadori、Paciucci和Spadea等认为阿糖胞苷(Ara-C)与米托蒽醌(MTZ)有时间依赖性协同作用[用药顺序应是先给VP-16,继之为阿糖胞苷(Ara-C),最后用米托蒽醌(MTZ)]。伊达比星(Ida) HD阿糖胞苷(AraC)获得的CR2率可能较高,但CR2期似并不更长。氟达拉滨是腺苷类药物,与阿糖胞苷(Ara-C)有协同作用,可提高细胞内阿糖胞苷(Ara-C)活性成分Ara-CTP的浓度。而G-CSF可增加静止期细胞对细胞毒药物的敏感性。一些作者采用FLAG方案[氟达拉滨25~30mg/m2·5天,阿糖胞苷(Ara-C)2g/m2·5天,G-CSF 5μg/kg与化疗同时起用直至中性粒细胞恢复],使难治、复发AML的CR率达50%~75%,CR和生存期分别为9.9和13个月,是近年报道疗效较好的方案之一。FLAG再加蒽环类能否进而改善疗效也在观察中。鉴于HD阿糖胞苷(AraC)(3g/m2 ×12天)有严重CNS、肝脏、骨髓抑制等毒性,老年患者耐受更差,有主张改用ID阿糖胞苷(AraC)[(0.5~2)g/m2·(6~8)次],认为可降低治疗相关死亡率,而总疗效(CR率和生存率)没有差别。
难治和复发AML的非HD阿糖胞苷(AraC)治疗方案有两类:一类是标准剂量阿糖胞苷(AraC)米托蒽醌(MTZ)依托泊苷(VP-16)、安吖啶(m-AMSA)或伊达比星(Ida)等;另一类不含阿糖胞苷(AraC),如依托泊苷(VP-16)联合米托蒽醌(MTZ)、安吖啶(m-AMSA)、阿柔比星(阿克拉霉素)或阿扎胞苷(5-azacytidine)等。两者CR率大都≤50%,缓解期更短。Brown等采用HD依托泊苷(VP-16)(总量1.8~4.2g/m2)加环磷酰胺HD(CTX)[50mg/kg·(3~4)天],难治AML获CR率42%,其中曾用HD阿糖胞苷(AraC)治疗证明耐药的病例,CR率也达30%,但主要毒性有黏膜炎,肝损害和出血性膀胱炎、且17%的患者死于骨髓抑制期合并严重感染。其他治疗还有卡铂、2-氯脱氧腺苷(2-chlorodeoxyadenosine,2-CdA)等。
影响复发患者疗效的因素除CR1期长短外,还有一线诱导和缓解后治疗强度。通常接受过强烈初次诱导及缓解后治疗的复发者对再治疗的反应将明显下降;缓解后于治疗中复发比完成并停止治疗后复发疗效更差;二次及多次复发不仅再缓解少见,缓解期也一次比一次缩短,最终难免死亡。影响复发患者疗效的其他不良因素尚有高龄(>50岁)、高白细胞数(>25×109/L)、白血病发病前有MDS等前驱血液病史,血清胆红素和碱性磷酸酶升高,以及某些高危细胞遗传学异常等。
由于难治和复发AML单用化疗的远期效果都很差,一般主张对年龄<55岁,有合适供者的原发难治患者和CR1<1~2年的复发病例采用异基因骨髓移植(Allo-BMT)。国际骨髓移植登记处(IBMTR)比较复发AML在CR2后使用Allo-BMT和继续单纯化疗的3年LFS,年龄<30岁,CR1≥1年的患者分别为41%和17%,年龄>30岁,CR1<1年的患者分别为18%和7%,显然Allo-BMT的疗效要明显优于单用化疗。
6.其他正在探索的新方法
实验证明拓扑异构酶工抑制剂拓扑替康可特异性与DNA单链断端上的拓扑异构酶Ⅰ结合,阻止拓扑异构酶Ⅰ对单链断端的修复,致DNA双链结构破坏,导致细胞死亡,因而具有抗肿瘤活性。Ⅰ期临床试验显示部分难治、复发AML单用拓扑替康可获CR,主要毒性是骨髓抑制和黏膜炎。拓扑替康(1~7mg/m2连续5天静脉输注)与含阿糖胞苷(AraC)标准方案及拓扑异构酶Ⅱ抑制剂联合,可能有增强抗白血病的作用,拓扑替康与环磷酰胺(CTX)、阿糖胞苷(AraC)、依托泊苷(VP-16)的联合治疗也在探索中。
MDR1基因过度扩增致细胞膜上P糖蛋白(P-gp)高表达是白血病细胞多药耐药(MDR)的主要机制,也是导致AML化疗失败或早期复发的重要因素。某些非细胞毒药物如环孢素A、环孢素D类似物PSC833有抑制MDRl/P-gp表达,延缓肝脏对葸环类和依托泊苷(VP-l6)的代谢、清除,维持体内化疗药有效浓度的作用,因此联合使用环孢素(CsA)和化疗有助改善这类病例的疗效。List等报道环孢素(CsA)联合柔红霉素(DNR) HD阿糖胞苷(ARAC)治疗原发难治和CR1<1年的复发AML,CR率67%。PSC833无免疫抑制作用及肾毒性,而对MDR1/P-gP的抑制效应比环孢素(CsA)强10倍,目前其疗效正在临床评价中,但有关环孢素(CsA)和PSC833的确切疗效机制仍待进一步阐明。
单克隆抗体(MoAb)治疗白血病近年获相当进展。由于>90%的AML表达CD33,而正常造血干细胞不表达,因此CD33是AML治疗较理想的靶抗原。抗CD33和抗CD45 MoAb还适于携带毒素、药物或放射性核素,以更有效地清除体内白血病细胞。目前研究较多的有HuMl95(未结合的抗CD33 MoAb)、CMA676(抗CD33 MoAb与抗肿瘤抗生素Calicheamicin的交联物)和131碘(131I),90钇(90Y),213铋(213Bi)标记的抗CD33、抗CD45 MoAb(如131I-HuMl95、213Bi-HuMl95、131I-抗CD45)等,临床使用这些MoAb治疗难治和复发AML,部分病例可获CR,或见骨髓幼稚细胞减少,而全身毒性较轻。鉴于有效病例大都治疗前骨髓白血病细胞<30%,因此认为MoAb可能对白血病细胞低负荷患者较有效,故还可用于AML巩固治疗后清除体内MRD。MoAb治疗AML-M3型的效果更满意,在ATRA诱导缓解后,应用化疗和HuM195(3mg/m2,每周2次),可使本病PML/RARα基因早期转阴,且转阴率高,患者的DFS显见延长。
采用去除T细胞的造血干细胞移植患者复发率高,间接证明供者T细胞介导移植物抗白血病(GVL)效应。1990年Kolb等首先发现供者淋巴细胞输注(DLI)有抗肿瘤作用。以后Collins等以DLI治疗Allo-BMT后复发的各种白血病,报道CML慢性期患者CR率73%,其中细胞遗传学/分子生物学复发者CR率100%,但DLI对Allo-BMT后复发的AML疗效较差,CR率仅15%~29%,而有效患者随后常出现髓外复发,这可能与AML的增殖活性,内源性耐药和白血病负荷高有关。DLI治疗的副作用主要是发生GVHD和骨髓抑制,是导致感染、死亡的常见原因。有人从小剂量开始,采用剂量递增,分多次给予DLI(D3 T细胞从6×l06/kg渐增至1×108/kg),或采用体外去除细胞毒CD8 T细胞,分离CD4 T细胞进行DLI,结果可明显减少GVHD的发生率,减轻GVHD的严重程度。
7.疗效标准
(1)完全缓解(CR):
①临床无白血病细胞浸润所致的症状和体征,生活正常或接近正常。
②血象:Hb≥100g/L或≥90g/L(女及儿童),中性粒细胞绝对值≥1.5×109/L,血小板≥100×109/L。外周血白细胞分类中无白血病细胞。
③骨髓象:原粒细胞Ⅰ Ⅱ型(原始单粒 幼稚单核细胞或原始淋巴 幼稚淋巴细胞)≤5%,红细胞及巨核细胞系正常。
M2b型原粒细胞 早幼粒细胞≤5%,中性中幼粒细胞比例正常范围。
M3型原粒细胞 早幼粒细胞≤5%。
M4型原粒细胞Ⅰ、Ⅱ型 原始及幼稚单核细胞≤5%。
M5型原单核Ⅰ型 Ⅱ型及幼稚单核细胞≤5%。
M6型原粒细胞Ⅰ型 Ⅱ型,原红细胞及幼红细胞比例基本正常。
M7型粒细胞、红细胞二系正常,原巨核细胞 幼稚巨核细胞基本消失。
ALL:淋巴母细胞 幼稚淋巴细胞≤5%。
(2)部分缓解(PR):
骨髓原粒细胞Ⅰ型 Ⅱ型(原单核 幼稚单核细胞或淋巴母细胞 幼稚淋巴细胞)>5%而≤20%;或临床、血象项中有一项未达完全缓解标准者。
(3)白血病复发有下列三者之一者称为复发:
①骨髓原粒细胞Ⅰ型 Ⅱ型(原单 幼单或原淋巴 幼淋)>5%又≤20%,经过有效抗白血病治疗一个疗程仍未能达到骨髓象完全缓解者。
②骨髓原粒细胞Ⅰ型 Ⅱ型(原单 幼单或原淋 幼淋)>20%者。
③骨髓外白血病细胞浸润。
(4)持续完全缓解(CCR):
指从治疗后完全缓解之日起计算,其间无白血病复发达3~5年以上者。
(5)长期存活:
急性白血病自确诊之日起,存活时间(包括无病或带病生存)达5年或5年以上者。
(6)临床治愈:
指停止化学治疗5年或DFS达10年者。
说明:凡统计生存率,应包括诱导治疗不足一疗程者;诱导治疗满一个疗程及其以上的病例应归入疗效统计范围。
二、预后
某单一因素常不能可靠地判断预后,应分析患者的全部信息,才能作出较为准确的推测。重要的预后因素如下:
1.年龄 老年(>60岁)及2岁以下的婴幼儿预后差。经充分治疗,15~60岁者5年无病生存率为10%,2~14岁的儿童则为60%。
2.继发性AML 如由MDS转化而来,或因其他良、恶性疾病经化、放疗后的AML,化疗反应差,或虽获CR,但CR期短。
3.细胞遗传学 在判断预后中有重要价值,t(15;17)的APL对ATRA反应好,致DIC已大为减少,CR后继续强联合化疗,约50%的病人可长期存活。有t(8;21)的M2型,CR率高,但如合并髓外病变,预后则差。inv(16)的M4E0型,CR率也较高,但易并发CNS-L,影响其预后,近经充分的HD-Ara-C治疗,预后已有改善。
继发性白血病常伴5.7号染色体异常,预后不良。3倍体8是AML染色体数量异常的最常见类型,预后差。伴复杂染色体异常的AML预后极差。
4.FAB分型 M0、M5、M6、M7型预后较差;原始细胞伴Auev小体、骨髓嗜酸细胞增多者预后较好。
5.治疗后骨髓反应 标准化疗方案后1周,至多2周达骨髓增生低下;一疗程即获CR者预后好。
6.免疫表型 AML的免疫表型对预后的影响报告不一,CD34和p170同时阳性者易耐药而预后不良。AML伴淋巴系免疫表型,尤其仅伴某一系淋巴细胞表型者预后不良。
7.伴高白细胞血症及髓外病变者预后较差 AML的死亡原因,依次为感染(70%)、出血(15%)、CNS-L(5%)、肝或肾功能衰竭(5%),以及贫血、全身衰弱。
疾病护理:
急性髓细胞白血病一般护理
急性髓细胞白血病护理
1、忌烟:香烟中的有害物质可以直接刺激呼吸道,烟雾会给周围人群的健康带来危害,所以,应彻底杜绝烟草。
2、忌寒凉食物:寒冷食物会刺激肠胃,所以为了更好的恢复,应少吃或不吃。
3、忌油炸及辛辣刺激食物,辛辣食物如辣椒、洋葱、 生蒜、胡椒粉等。
疾病饮食:
急性髓细胞白血病饮食原则
急性髓细胞白血病饮食保健
1、高蛋白:白血病是血细胞发生了病理改变所致,这类病人机体内蛋白质的消耗量远远大于正常人,只有补充量多质优的蛋白质,才能维持各组织器官的功能。蛋白质另一功能是构成抗体,具有保护机体免受细菌和病毒的侵害,提高机体抵抗力的作用。所以,白血病患者应摄人高蛋白饮食,特别是多选用一些质量好、消化与吸收率高的植物性蛋白和豆类蛋白质,如、豆腐、豆腐脑、豆腐干、腐竹、豆浆等。以补充身体对蛋白质的需要。
2、多进食含维生素丰富的食物:临床资料证明,恶性肿瘤患者中约有70~90%的人体内有不同程度的维生素缺乏。国外医学研究证明多吃富含维生素C的蔬菜与水果,能阻止癌细胞生成扩散。摄人大量维生素C,还能增强机体的局部基质抵抗力和全身免疫功能,从而达到控制和治疗癌症的目的。含维生素C丰富的食物有油菜、雪里蕻、西红柿、小白莱、韭莱、荠莱、山楂、柑桔、鲜枣、猕猴桃、沙棘及柠檬等。这是白血病吃什么好的最重要的一条。
维生素A可刺激机体免疫系统,调动机体抗癌的积极性、抵抗致病物侵人机体。含维生素A丰富的食物有胡萝卜、南瓜、苜蓿、柿子椒以及菠莱等。
维生素可分为水溶性和脂溶性的,水溶性的维生素有VitC和B族维生素,脂溶性维生素有A、D、E、K,水溶性的维生素人体容易吸收也容易从体液里流失,若不及时补充会造成维生素缺乏症。脂溶性的维生素,容易储存在脂肪组织和肝脏,从胆汁缓慢排出体外,所以过量会导致中毒。人体维生素要合理搭配补充,不能多也不能少,适量补充。维生素的缺乏也会使酸性的形成,人体要从植物中去补充所需维生素。
3、多摄入含铁质丰富的食物:白血病的主要表现之一是贫血,所以在药物治疗的同时,鼓励病人经常食用一些富含铁的食物,如动豌豆、黑豆、绿色蔬菜、大枣、红糖、黑木耳、芝麻酱、蛋黄等。
4、少食多餐,容易消化:白血病患者,尤其在治疗过程中,消化系统往往会出现诸多反应如恶心、呕吐、腹胀、腹泻等症状,此时可采取少食多餐的进食方法,或在三餐之外,增加一些体积小、热量高、营养丰富的食品,如糕点、巧克力、面包、猕猴桃、鲜蔬汁等。消化系统的不良反应,病人要多摄入碱性食物,以减轻消化道的不适,根据病情对症调理饮食:病人如有食纳不佳、消化不良时,可供给半流质或软饭,如二米粥、蒸蛋羹、酸奶、豆腐脑、小笼包子等,同时可佐以山楂、萝卜等消导性食物。







